题目内容
11.(1)常温下,0.1mol•L-1NH4Cl溶液pH<7(填“>”、“=”或“<”),原因是:NH4++H2O?NH3•H2O+H+(写出有关的离子方程式),溶液中各离子浓度由大到小的顺序是c(Cl-)>c(NH4+)>c(H+)>c(OH-).(2)0.1mol•L NaNO2溶液与0.1mol•L CH3COONa溶液pH大小关系为:
NaNO2< CH3COONa(填“>”“=“或”“<”).(已知HNO2的电离常数Ka=7.1×10-4mol•L-1,CH3COOH的电离常数Ka=1.8×10-5mol•L-1).
(3)一定条件下的可逆反应2NO2(g)?N2O4 (g)△H=-92.4kJ/mol达到化学平衡状态且其它条件不变时,如果升高温度,平衡混合物的颜色变深(填“变深”或“变浅”);如果在体积固定的容器中加入一定量的二氧化氮,化学平衡向正反应方向移动.(填“正反应”或“逆反应”).
分析 (1)氯化铵溶液中铵根离子水解溶液显酸性;
(2)已知HNO2的电离常数Ka=7.1×10-4mol•L-1,CH3COOH的电离常数Ka=1.7×10-5mol•L-1,酸性HNO2>CH3COOH,酸越弱对应盐水解程度程度越大;
(3)2NO2(g)?N2O4 (g)△H=-92.4kJ/mol,正反应放热,升高温度平衡向逆反应方向移动;增大反应的浓度,平衡向正反应方向移动.
解答 解:(1)NH4Cl溶液中铵根离子水解,溶液显酸性,离子方程式为:NH4++H2O?NH3•H2O+H+,NH4Cl溶液中离子浓度由大到小的顺序为c(Cl-)>c(NH4+)>c(H+)>c(OH-),
故答案为:<;NH4++H2O?NH3•H2O+H+;c(Cl-)>c(NH4+)>c(H+)>c(OH-);
(2)已知HNO2的电离常数Ka=7.1×10-4mol•L-1,CH3COOH的电离常数Ka=1.7×10-5mol•L-1,酸性HNO2>CH3COOH,0.1mol•L NaNO2溶液与0.1mol•L CH3COONa溶液水解程度 CH3COONa大,溶液碱性强,溶液PH大,NaNO2<CH3COONa,
故答案为:<;
(3)正反应为放热反应,升高温度平衡向逆反应方向移动,则颜色变深,如果在体积固定容器中加入一定量的二氧化氮,增大反应的浓度,平衡向正反应方向移动,
故答案为:变深; 正反应.
点评 本题考查盐类水解、化学平衡的影响因素、弱电解质电离平衡的分析判断,题目难度不大,注意把握平衡移动原理的分析应用.

练习册系列答案
相关题目
19.用 0.50mol•L-1NaOH标准液10.00mL,将未知浓度的盐酸20.00mL恰好滴定至终点,下列说法正确的是( )
| A. | 若选用酚酞作指示剂,终点时,液体恰好褪色 | |
| B. | 用量筒量取上述盐酸 | |
| C. | 若滴定完毕,滴定管尖嘴悬有一滴液体,则所测的盐酸浓度偏大 | |
| D. | 盐酸的浓度为1.00 mol•L-1 |
6.下列说法正确的是( )
| A. | 可加入酸性KMnO4溶液鉴别苯、乙醇和四氯化碳 | |
| B. | 碳酸钠溶液、蛋白质溶液均具有丁达尔效应 | |
| C. | 煤的干馏、石油的分馏、油脂的水解都是化学变化 | |
| D. | 蔗糖与稀硫酸溶液共热后加入银氨溶液,再水浴加热产生银镜,证明蔗糖水解产物中有葡萄糖 |
16.下列物质的提纯方法可能属于化学变化的是 )
| A. | 蒸馏 | B. | 渗析 | C. | 过滤 | D. | 洗气 |
20.下列物质中,是人体必需的营养成分之一,给人体提供能量的是( )
| A. | 食盐 | B. | 水 | C. | 糖类 | D. | 陈醋 |
1.用NA表示阿伏伽德罗常数的值.下列判断正确的是( )
| A. | 1 g H2含有的氢原子数目为2NA | |
| B. | 常温常压下,22.4 L O2含有的分子数目为NA | |
| C. | 1 L 1 mol•L-1 KOH溶液中含有的钾离子数目为NA | |
| D. | 1 mol Zn变为Zn2+失去的电子数目为NA |
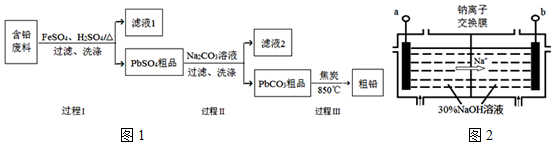
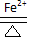 2PbSO4+2H2O.
2PbSO4+2H2O. 烃A是一种重要的化工原料.己知A在标准状况下的密度为1.16g•L-1,B可发生银镜反应.它们之间的转化关系如图:请回答:
烃A是一种重要的化工原料.己知A在标准状况下的密度为1.16g•L-1,B可发生银镜反应.它们之间的转化关系如图:请回答: