题目内容
(1)根据表格的信息回答问题:
①根据表中数据,将浓度均为0.1mol?L-1的下列四种酸溶液分别稀释100倍,pH变化最小的是 .
A.HCN B.HClO C.H2CO3 D.CH3COOH
②根据以上数据,判断下列反应可以成立的是
A.CH3COOH+Na2CO3═NaHCO3+CH3COONa B.CH3COOH+NaCN═HCN+CH3COONa
C.CO2 +H2O+NaClO═Na2CO3+2HClO D.NaHCO3+HCN═NaCN+CO2 +H2O.
(2)几种离子开始沉淀时的pH如下:
当向含相同浓度Fe2+、Cu2+、Mg2+的离子的溶液中滴加NaOH溶液时, (填写离子符号)沉淀,Ksp[Fe(OH)2 ] Ksp[Mg(OH)2](填“大于”、“等于”或“小于”).
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 |
A.HCN B.HClO C.H2CO3 D.CH3COOH
②根据以上数据,判断下列反应可以成立的是
A.CH3COOH+Na2CO3═NaHCO3+CH3COONa B.CH3COOH+NaCN═HCN+CH3COONa
C.CO2 +H2O+NaClO═Na2CO3+2HClO D.NaHCO3+HCN═NaCN+CO2 +H2O.
(2)几种离子开始沉淀时的pH如下:
| 离子 | Fe2+ | Cu2+ | Mg2+ |
| pH | 7.6 | 5.2 | 10.4 |
考点:盐类水解的应用,难溶电解质的溶解平衡及沉淀转化的本质
专题:
分析:(1)①相同浓度的钠盐溶液,酸的酸性越弱,则酸根离子水解程度越大,根据钠盐溶液pH确定酸的强弱;相同浓度的不同酸,加水稀释促进弱酸电离,则稀释相同的倍数,酸的酸性越弱,酸溶液稀释过程中pH变化越小;
②酸根离子水解程度越强,则酸的酸性越弱,结合强酸制取弱酸分析;
(2)生成沉淀需要的pH越小,则该离子先沉淀;根据离子积常数计算其溶度积常数.
②酸根离子水解程度越强,则酸的酸性越弱,结合强酸制取弱酸分析;
(2)生成沉淀需要的pH越小,则该离子先沉淀;根据离子积常数计算其溶度积常数.
解答:
解:(1)①相同浓度的钠盐溶液,酸的酸性越弱,则酸根离子水解程度越大,根据钠盐溶液pH确定酸的强弱;相同浓度的不同酸,加水稀释促进弱酸电离,则稀释相同的倍数,酸的酸性越弱,酸溶液稀释过程中pH变化越小,根据钠盐溶液的pH知,HCN、HClO、CH3COOH、H2CO3四种酸的酸性大小顺序是CH3COOH>H2CO3>HClO>HCN,所以溶液的pH变化最小的是HCN,
故选A;
②HCN、HClO、CH3COOH、H2CO3四种酸的酸性大小顺序是CH3COOH>H2CO3>HClO>HCN,根据强酸制取弱酸知,
A.酸性CH3COOH>H2CO3>HCO3-,所以二者反应为CH3COOH+Na2CO3═NaHCO3+CH3COONa,故正确;
B.醋酸酸性大于HCN,所以二者反应为CH3COOH+NaCN═CH3COONa+HCN,故正确;
C.碳酸酸性大于次氯酸,所以二者反应为CO2+H2O+NaClO═NaHCO3+NaClO,故错误;
D.酸性H2CO3>HClO>HCN,所以NaHCO3、HCN二者不反应,故错误;
故选AB;
(2)Cu2+开始沉淀的pH最小,所以Cu2+先沉淀;Mg2+、Fe2+开始沉淀的C(OH-)分别为:10-3.6mol?L-1、10-6.4mol?L-1,所以KSP[(Fe(OH)2]<KSP[(Mg(OH)2],
故答案为:Cu2+;<.
故选A;
②HCN、HClO、CH3COOH、H2CO3四种酸的酸性大小顺序是CH3COOH>H2CO3>HClO>HCN,根据强酸制取弱酸知,
A.酸性CH3COOH>H2CO3>HCO3-,所以二者反应为CH3COOH+Na2CO3═NaHCO3+CH3COONa,故正确;
B.醋酸酸性大于HCN,所以二者反应为CH3COOH+NaCN═CH3COONa+HCN,故正确;
C.碳酸酸性大于次氯酸,所以二者反应为CO2+H2O+NaClO═NaHCO3+NaClO,故错误;
D.酸性H2CO3>HClO>HCN,所以NaHCO3、HCN二者不反应,故错误;
故选AB;
(2)Cu2+开始沉淀的pH最小,所以Cu2+先沉淀;Mg2+、Fe2+开始沉淀的C(OH-)分别为:10-3.6mol?L-1、10-6.4mol?L-1,所以KSP[(Fe(OH)2]<KSP[(Mg(OH)2],
故答案为:Cu2+;<.
点评:本题考查较综合,涉及离子浓度大小比较、弱电解质的电离、难溶物的溶解平衡等知识点,根据溶液中的溶质及其性质确定溶液中离子浓度大小,知道酸的强弱与酸根离子水解程度的关系,知道弱电解质稀释过程中各种离子浓度变化,题目难度中等.

练习册系列答案
相关题目
下列反应是制取某一种香料的中间过程: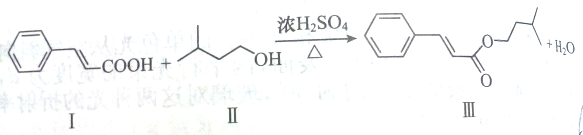
下列有关说法正确的是( )

下列有关说法正确的是( )
| A、Ⅱ物质的名称为2-甲基-4-丁醇 |
| B、Ⅲ物质的分子式为C14H18O2 |
| C、Ⅰ物质的9个碳原子一定共面 |
| D、Ⅲ物质中有3种官能团 |
下列说法正确的是( )
| A、浓硫酸有吸水性,可用于干燥氨气 |
| B、SiO2是酸性氧化物,能与NaOH溶液反应 |
| C、Na2O2与水反应、红热的Fe与水蒸气反应均能生成碱 |
| D、新制氯水显酸性,滴加少量紫色石蕊溶液,溶液始终呈红色 |
使H2SO4与过量Zn反应速率下降但不影响H2 的量,应加入( )
| A、Na2CO3 (s) |
| B、(NH4)2SO4 (s) |
| C、K2SO4 (aq) |
| D、H2O (l) |
| E、CH3COONa(s) |
 H2S是一种无色、有毒的可燃性气体,其水溶液叫氢硫酸(二元弱酸).
H2S是一种无色、有毒的可燃性气体,其水溶液叫氢硫酸(二元弱酸). 某实验小组用MnO2与浓盐酸混合加热制取Cl2,并将制得的氯气与潮湿的Ca(OH)2固体反应制取少量漂白粉.实验装置如图:回答下列问题.
某实验小组用MnO2与浓盐酸混合加热制取Cl2,并将制得的氯气与潮湿的Ca(OH)2固体反应制取少量漂白粉.实验装置如图:回答下列问题.