题目内容
13.15g某金属混合物与足量盐酸完全反应,生成的氢气在标准状况下的体积为11.2L,则该混合物可能是( )| A. | Mg、Al | B. | Mg、Fe | C. | Zn、Fe | D. | Al、Zn |
分析 假设金属都为+2价,根据M=$\frac{m}{n}$计算出金属混合物的平均摩尔质量,然后利用平均值法进行判断;注意Al为+2价时的摩尔质量为:$\frac{27g/mol×2}{3}$=18g/mol.
解答 解:11.2L氢气的物质的量为:$\frac{11.2L}{22.4L/mol}$=0.5mol,
假设金属都为+2价,则金属混合物的平均相对原子质量为:$\frac{15g}{0.5mol}$=30g/mol,
A.Mg的摩尔质量为24g/mol,Al为+2价时的摩尔质量为:$\frac{27g/mol×2}{3}$=18g/mol,平均摩尔质量不可能为30g/mol,故A错误;
B.Mg的摩尔质量为24g/mol,Fe的摩尔质量为56g/mol,平均值可能为30g/mol,故B正确;
C.Zn的摩尔质量为65g/mol,Fe的摩尔质量为56g/mol,平均值不可能为30g/mol,不符合题意,故C错误;
D.Al为+2价时的摩尔质量为:$\frac{27g/mol×2}{3}$=18g/mol,Zn的摩尔质量为65g/mol,平均值可能为30g/mol,故D正确;
故选BD.
点评 本题考查混合物反应的计算,题目难度中等,本题利用平均值法计算,注意化合价与相对原子质量的关系,试题培养了学生的化学计算能力.

练习册系列答案
 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案
相关题目
8.化学与生活密切相关,下列叙述正确的是( )
| A. | 光纤通信使用的光缆主要成分是Si,太阳能电池使用的材料主要是SiO2 | |
| B. | 点燃爆竹后,硫燃烧生产SO3 | |
| C. | 海水中含有溴元素,只进行物理变化就可以得到溴单质 | |
| D. | “地沟油”禁止使用,但可以用来制取肥皂 |
5.下列各种物质既能与强酸溶液反应又能与强碱溶液反应的是( )
①Al ②AlCl3 ③Na AlO2 ④Al(OH)3 ⑤Al2O3 ⑥NaHCO3.
①Al ②AlCl3 ③Na AlO2 ④Al(OH)3 ⑤Al2O3 ⑥NaHCO3.
| A. | ①②③④⑤⑥ | B. | ①③④⑤ | C. | ④⑤ | D. | ①④⑤⑥ |
3.下列离子在溶液中能大量共存的是( )
| A. | Fe3+、Al3+、SCN-、Cl- | B. | Fe3+、Na+、S2-、Cl- | ||
| C. | K+、H+、Cl-、AlO2- | D. | Na+、Ca2+、HCO3-、Cl- |
 用如图所示装置进行中和热测定实验,请回答下列问题:
用如图所示装置进行中和热测定实验,请回答下列问题:
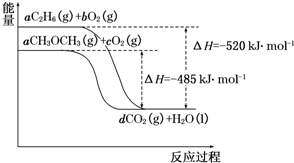 当今世界,能源的发展日益成为全世界、全人类共同关心的问题.如图是乙烷(C2H6)、二甲醚(CH3OCH3)燃烧过程的能量变化图.请回答下列问题:
当今世界,能源的发展日益成为全世界、全人类共同关心的问题.如图是乙烷(C2H6)、二甲醚(CH3OCH3)燃烧过程的能量变化图.请回答下列问题: