题目内容
4.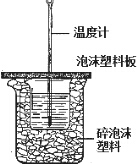 用如图所示装置进行中和热测定实验,请回答下列问题:
用如图所示装置进行中和热测定实验,请回答下列问题:(1)从实验装置上看,图中缺少的一种玻璃仪器是环形玻璃搅拌棒.
(2)使用补全仪器后的装置进行实验,取50mL0.25mol/L H2SO4溶液与 50mL 0.55mol/L NaOH溶液在小烧杯中进行中和反应,三次实验温度平均升高3.4℃.已知中和后生成的溶液的比热容c为 4.18J/(g•℃),溶液的密度均为1g/cm3.通过计算可得中和热△H=-56.8kJ/mol.
分析 (1)根据量热计的构造来判断该装置的缺少仪器;
(2)根据Q=m•c•△T计算,先根据Q=m•c•△T计算反应放出的热量,然后根据△H=-$\frac{Q}{n}$kJ/mol计算出反应热;
解答 解:(1)根据量热计的构造可知该装置的缺少仪器是环形玻璃搅拌棒;
故答案为:环形玻璃搅拌棒;
(2)50mL0.25mol/L H2SO4溶液与 50mL 0.55mol/L NaOH溶液进行中和反应生成水的物质的量为0.05L×0.25mol/L×2=0.025mol,溶液的质量为:100ml×1g/ml=100g,温度变化的值△T为3.4℃,则生成0.025mol水放出的热量为Q=m•c•△T=100g×4.18J/(g•℃)×3.4℃=1421.2J,即1.421kJ,所以实验测得的中和热△H=-$\frac{1.421kJ}{0.025mol}$=-56.8 kJ/mol;
故答案为:-56.8kJ/mol;
点评 本题考查中和热的测定与计算,题目难度中等,注意理解中和热的概念,注意掌握测定中和热的正确方法,明确实验操作过程中关键在于尽可能减少热量散失.

练习册系列答案
 初中暑期衔接系列答案
初中暑期衔接系列答案
相关题目
11.氢气还原氧化铜:CuO+H2 $\frac{\underline{\;\;△\;\;}}{\;}$Cu+H2O,在该反应中( )
| A. | CuO做氧化剂 | B. | Cu做还原剂 | ||
| C. | 铜是氧化产物 | D. | 铜元素化合剂升高 |
16.绿柱石被国际珠宝界公认为四大名贵宝石之一.主要成分为Be3Al2[Si6O18],因含适量的Cr2O3(0.15~0.6%),而形成祖母绿.试回答下列问题:
(1)基态Al原子中,电子填充的最高能级是3p,基态Cr原子的价电子排布式是3d54s1.
(2)用“>”或“<”填空:
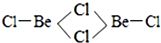
(3)BeCl2分子的空间构型是直线型,它的二聚体Be2Cl4结构如右图所示,其中Be原子的杂化方式是sp3.
(4)强还原剂LiAlH4能将SiCl4还原成SiH4,试写出SiH4在空气中自燃的化学方程式SiH4+2O2=SiO2+2H2O.
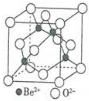
(5)Be的氧化物的立方晶胞结构如右图所示,已知氧化铍晶体的密度为ρg•cm-3,则晶胞连长为$\root{3}{\frac{100}{ρ{N}_{A}}}$cm(设NA为阿伏加德罗常数的值,用含NA、ρ的代数式表示).
(1)基态Al原子中,电子填充的最高能级是3p,基态Cr原子的价电子排布式是3d54s1.
(2)用“>”或“<”填空:
| 第一电离能 | 键能 | 沸点 | 离子半径 |
| Be>B | C-C>Si-Si | H2S<H2O | Al3+<O2- |

(4)强还原剂LiAlH4能将SiCl4还原成SiH4,试写出SiH4在空气中自燃的化学方程式SiH4+2O2=SiO2+2H2O.
(5)Be的氧化物的立方晶胞结构如右图所示,已知氧化铍晶体的密度为ρg•cm-3,则晶胞连长为$\root{3}{\frac{100}{ρ{N}_{A}}}$cm(设NA为阿伏加德罗常数的值,用含NA、ρ的代数式表示).

13.15g某金属混合物与足量盐酸完全反应,生成的氢气在标准状况下的体积为11.2L,则该混合物可能是( )
| A. | Mg、Al | B. | Mg、Fe | C. | Zn、Fe | D. | Al、Zn |
 有一透明溶液,可能含有较大量的Mg2+、Fe3+、Al3+、Cu2+、Na+、H+、SO42-、CO32-中的一种或几种,取此溶液做下列实验
有一透明溶液,可能含有较大量的Mg2+、Fe3+、Al3+、Cu2+、Na+、H+、SO42-、CO32-中的一种或几种,取此溶液做下列实验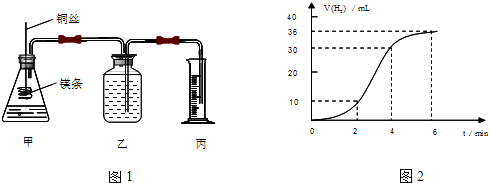
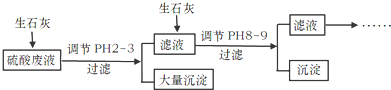
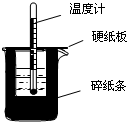 50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题: