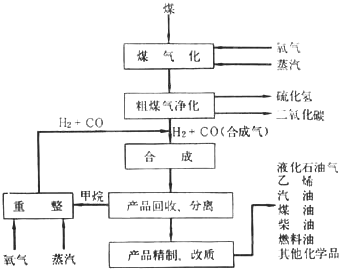
题目内容
 钒(V)及其化合物广泛应用于工业催化、新材料和新能源等领域.
钒(V)及其化合物广泛应用于工业催化、新材料和新能源等领域.(1)V2O5是接触法制硫酸的催化剂.
①已知25℃.101kPa时:
2SO2(g)+O2(g)+2H2O(l)═2H2SO4(l)△H=-457kJ?mol-1
SO3(g)+H2O(l)═H2SO4(l)△H=-130kJ?mol-1
则反应2SO2(g)+O2(g)?2SO3(g)的△H=
②SO2水溶液可与SeO2反应得到硫酸,当有79g Se生成时,转移电子的物质的量为
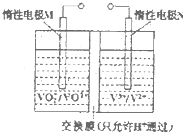
(2)全钒液流电池的结构如图所示,其电解液中含有钒的不同价态的离子、H+和SO42-.电池放电时,负极的电极反应为:V2+-e-=V3+.
①电池放电时的总反应方程式为
②若电池初始时左、右两槽内均以VOSO4和H2SO4的混合液为电解液,使用前需先充电激活,充电过程阴极区的反应分两步完成:第一步VO2+转化为V3+;第二步V3+转化为V2+.则第一步反应过程中阴极区溶液n(H+)
考点:热化学方程式,化学电源新型电池,氧化还原反应的计算
专题:基本概念与基本理论
分析:(1)①用盖斯定律解答;催化剂能降低反应的活化能;
②SO2是还原剂,SeO2是氧化剂,Se由+4价变为0价,据电子守恒书写化学方程式;
(2)①电池正极反应式为:VO2++2H++e-=VO2++H2O,与负极反应式:V2+-e-=V3+,相加即可得总反应方程式;放电时M电极发生还原反应,充电时必须发生氧化反应,解电源的正极;
②充电是电解过程,阴极区第一步VO2+转化为V3+;需要氢离子结合氧原子,所以,n(H+)减小;阳极发生氧化反应,发生的反应为VO2++H2O-e-=VO2++2H+.
②SO2是还原剂,SeO2是氧化剂,Se由+4价变为0价,据电子守恒书写化学方程式;
(2)①电池正极反应式为:VO2++2H++e-=VO2++H2O,与负极反应式:V2+-e-=V3+,相加即可得总反应方程式;放电时M电极发生还原反应,充电时必须发生氧化反应,解电源的正极;
②充电是电解过程,阴极区第一步VO2+转化为V3+;需要氢离子结合氧原子,所以,n(H+)减小;阳极发生氧化反应,发生的反应为VO2++H2O-e-=VO2++2H+.
解答:
解:(1)①已知:①2SO2(g)+O2(g)+2H2O(l)═2H2SO4(l)△H=-457kJ?mol-1
②SO3(g)+H2O(l)═H2SO4(l)△H=-130kJ?mol-1据盖斯定律,①-2×②得:2SO2(g)+O2(g)?2SO3(g)△H=-197KJ/mol;催化剂能降低反应的活化能,所以使用V2O5作催化剂后该反应逆反应的活化能降低,故答案为:-197;减小;
②SO2是还原剂,SeO2是氧化剂,Se由+4价变为0价,当有1molSe生成时,应转移4mol电子,据电子守恒可写出反应方程式为:2SO2+SeO2+2H2O=2H2SO4+Se,
故答案为:4;2SO2+SeO2+2H2O=2H2SO4+Se;
(2)①电池正极反应式为:VO2++2H++e-=VO2++H2O,与负极反应式:V2+-e-=V3+,相加即可得总反应方程式为:VO2++2H++V2+=VO2++H2O+V3+,放电时M电极发生还原反应,充电时必须发生氧化反应,解电源的正极,故答案为:VO2++2H++V2+=VO2++H2O+V3+;正;
②充电是电解过程,阴极区第一步VO2+转化为V3+;需要氢离子结合氧原子,所以,n(H+)减小;阳极发生氧化反应,发生的反应为VO2++H2O-e-=VO2++2H+,故答案为:减小;VO2++H2O-e-=VO2++2H+.
②SO3(g)+H2O(l)═H2SO4(l)△H=-130kJ?mol-1据盖斯定律,①-2×②得:2SO2(g)+O2(g)?2SO3(g)△H=-197KJ/mol;催化剂能降低反应的活化能,所以使用V2O5作催化剂后该反应逆反应的活化能降低,故答案为:-197;减小;
②SO2是还原剂,SeO2是氧化剂,Se由+4价变为0价,当有1molSe生成时,应转移4mol电子,据电子守恒可写出反应方程式为:2SO2+SeO2+2H2O=2H2SO4+Se,
故答案为:4;2SO2+SeO2+2H2O=2H2SO4+Se;
(2)①电池正极反应式为:VO2++2H++e-=VO2++H2O,与负极反应式:V2+-e-=V3+,相加即可得总反应方程式为:VO2++2H++V2+=VO2++H2O+V3+,放电时M电极发生还原反应,充电时必须发生氧化反应,解电源的正极,故答案为:VO2++2H++V2+=VO2++H2O+V3+;正;
②充电是电解过程,阴极区第一步VO2+转化为V3+;需要氢离子结合氧原子,所以,n(H+)减小;阳极发生氧化反应,发生的反应为VO2++H2O-e-=VO2++2H+,故答案为:减小;VO2++H2O-e-=VO2++2H+.
点评:本题考查了盖斯定律及氧化还原反应中的电子守恒,关于电池,在原电池中负极失去电子,为还原剂发生氧化反应,正极得到电子,为氧化剂发生还原反应,在电解池中,与电源正极相连为阳极,发生氧化反应,失去电子,与电源负极相连的阴极,发生还原反应,得到电子.

练习册系列答案
相关题目
下列说法不正确的是( )
| A、将等体积、等物质的量浓度的HA(HA为弱酸)与NaA混合,所得混合液的酸碱性取决于Ka(HA)的大小 | ||
| B、等物质的量的NaClO、NaHCO3混合溶液中:c(HClO)+c(ClO-)=c(HCO3-)+c(H2CO3)+c(CO32-) | ||
| C、某氨水的pH=a,某盐酸的pH=b,已知a+b=14,将上述氨水与盐酸等体积混合后,溶液中各种离子浓度的关系为:c(NH4+)>c(Cl-)>c(OH-)>c(H+) | ||
D、CH3COOH 溶液加水稀释后,溶液中
|
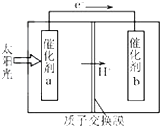 人工光合作用能够借助太阳能,用CO2和H2O制备化学原料.如图是通过人工光合作用制备HCOOH的原理示意图,下列说法不正确的是( )
人工光合作用能够借助太阳能,用CO2和H2O制备化学原料.如图是通过人工光合作用制备HCOOH的原理示意图,下列说法不正确的是( )| A、催化剂a附近酸性减弱,催化剂b附近酸性增强 |
| B、催化剂a表面发生氧化反应,有O2产生 |
| C、该过程是将太阳能转化为化学能的过程 |
| D、催化剂b表面的反应是CO2+2H++2e-═HCOOH |
下列反应的离子方程式不正确的是( )
| A、将CO2通入到纯碱饱和溶液中:2Na++CO32-+CO2+H2O═2NaHCO3↓ | ||||
| B、在含有等物质的量的Fe(NO3)2和KI组成的混合溶液中滴入稀盐酸:3Fe2++4H++NO3-═3Fe3++NO↑+2H2O | ||||
| C、向Ba(OH)2溶液中加入足量的NH4HCO3溶液:Ba2++2OH-+2HCO3-═BaCO3↓+CO32-+2H2O | ||||
D、将饱和FeCl3溶液滴入沸水中制胶体:Fe3++3H2O
|

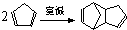 ,反应类型为
,反应类型为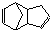 外,还有与双环戊二烯为同分异构体的其他副产物,写出其中一种的结构简式
外,还有与双环戊二烯为同分异构体的其他副产物,写出其中一种的结构简式