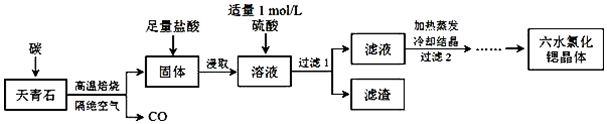
题目内容
10.设NA为阿伏加德罗常数值.下列有关叙述正确的是( )| A. | 13g乙炔中含有共用电子对的数目为1.5NA | |
| B. | 含有2NA个氧原子的氧气和臭氧的混合气体的质量为32g | |
| C. | 1 mol•L-1碳酸钠溶液中含有的碳酸根离子的数目小于NA | |
| D. | 标准状况下,将22.4LCl2通入水中发生反应,转移的电子数为NA |
分析 A.乙炔中含有2个碳氢键、3对碳碳共用电子对,共5对电子对;
B.氧气与臭氧都是由氧原子构成,依据m=$\frac{N}{N{\;}_{A}}$M计算;
C.溶液体积未知;
D.氯气与水反应为可逆反应,不能进行到底.
解答 解:A.13g乙炔物质的量为:$\frac{13g}{26g/mol}$=0.5mol,含有共用电子对的数目为2.5NA,故A错误;
B.含有2NA个氧原子的氧气和臭氧的混合气体的质量为:$\frac{2N{\;}_{A}}{N{\;}_{A}}$×16g/mol=32g,故B正确;
C.溶液体积未知,无法计算碳酸根离子个数,故C错误;
D.氯气与水反应为可逆反应,不能进行到底,所以标准状况下,将22.4LCl2物质的量为:$\frac{22.4L}{22.4L/mol}$=1mol,通入水中发生反应,氯气不能完全反应,所以转移的电子数小于NA,故D错误;
故选:B.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大,注意乙炔结构特点,注意可逆反应不能进行到底的特点.

练习册系列答案
 本土教辅赢在暑假高效假期总复习云南科技出版社系列答案
本土教辅赢在暑假高效假期总复习云南科技出版社系列答案 暑假作业北京艺术与科学电子出版社系列答案
暑假作业北京艺术与科学电子出版社系列答案 第三学期赢在暑假系列答案
第三学期赢在暑假系列答案
相关题目
20.下列化学用语中书写正确的是( )
| A. | 原子核内有10 个中子的氧原子:${\;}_{8}^{18}$O | |
| B. | 次氯酸的结构式:H-Cl-O | |
| C. | CO2的比例模型: | |
| D. | 溴化铵的电子式: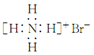 |
1.新型锌-空气电池的储存电量是锂电池的三倍,成本是锂电池的一半.这种电池使用特殊材料吸附空气中的氧,电池放电时总反应:2Zn+O2+4OH-+2H2O═2Zn(OH)42-,电解液是KOH溶液.下列有关该电池的说法正确的是( )
| A. | 锌是负极,发生还原反应 | |
| B. | O2在正极发生氧化反应 | |
| C. | 工作一段时间后,电解质溶液的碱性会减弱 | |
| D. | 该电池能将化学能全部转化为电能 |
18.下列实验操作或装置中的药品使用正确的是( )
| A. |  配制溶液 | B. |  证明非金属性强弱:C>Si | ||
| C. |  除去CO2中的HCl | D. |  证明SO2有漂白性 |
15.紫苏醇可抑制肿瘤发生,其结构简式如图,下列有关紫苏醇的叙述正确的是( )
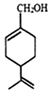

| A. | 分子式为C10H16O | |
| B. | 紫苏醇为芳香族化合物 | |
| C. | 环上的一氯取代物有四种 | |
| D. | 使酸性高锰酸钾溶液和溴水褪色的原理相同 |
2.一定条件下,下列金属中能与水发生置换反应并产生金属氧化物的是( )
| A. | 钾 | B. | 镁 | C. | 铁 | D. | 铜 |
3.将铁粉和硫粉混合后加热,发生反应后熄灭酒精灯,反应仍然进行直到反应结束,该现象说明了( )
| A. | 铁粉的能量高于FeS | |
| B. | 铁粉和硫粉的反应常温下不能自发进行 | |
| C. | 该反应是放热反应 | |
| D. | 该反应不会产生污染物 |