题目内容
2.设NA 为阿伏加德罗常数的值.下列说法正确的是( )| A. | 0.1molN2与足量的H2反应,转移的电子数是0.6NA | |
| B. | 0.1 mol羟基( )中含有的电子数为0.7 NA )中含有的电子数为0.7 NA | |
| C. | 0.1 mol•L-1 MgCl2溶液中含有的Mg2+数目一定小于0.1 NA | |
| D. | 在精炼铜或电镀铜的过程中,当阴极析出铜32g,转移电子数均为NA |
分析 A、氮气和氢气的反应为可逆反应;
B、羟基中含9个电子;
C、溶液体积不明确;
D、在电解精炼铜或电镀铜的过程中,阴极上的反应均为:Cu2++2-=Cu.
解答 解:A、氮气和氢气的反应为可逆反应,故不能进行彻底,故转移的电子数小于0.6NA个,故A错误;
B、羟基中含9个电子,故0.1mol-OH中含0.9NA个电子,故B错误;
C、溶液体积不明确,故溶液中的镁离子的个数无法计算,故C错误;
D、在电解精炼铜或电镀铜的过程中,阴极上的反应均为:Cu2++2-=Cu,故当阴极上析出32g铜即0.5mol铜时,转移的电子数为NA个,故D正确.
故选D.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
相关题目
17.下列说法正确的是( )
| A. | 对一个可逆反应,正反应方向是吸热的,当升高温度时,正反应速率增大,逆反应速率减小 | |
| B. | 正催化剂能提高活化分子百分数和活化分子浓度 | |
| C. | 压强增大,化学反应速率一定增大 | |
| D. | 浓度升高化学平衡一定发生移动 |
7.下列有关电解质溶液的说法正确的是( )
| A. | 向0.1mol•L-1CH3COOH溶液中加入少量水,溶液中$\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$减小 | |
| B. | 将CH3COONa溶液从20℃升温至30℃,溶液中$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)•c(O{H}^{-})}$增大 | |
| C. | 向盐酸中加入氨水至中性,溶液中$\frac{c(N{H}_{4}^{+})}{c(C{l}^{-})}$>1 | |
| D. | 0.1mol/LNa2CO3与0.1mol/L NaHCO3溶液等体积混合:$\frac{2}{3}$c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3) |
14.已知一种c(H+)=1×10-3 mol/L的酸和一种c(OH-)=1×10-3mol/L的碱等体积混合后溶液呈酸性,其原因可能是( )
| A. | 浓的强酸和稀的强碱反应 | B. | 浓的弱酸和稀的强碱反应 | ||
| C. | 等浓度的强酸和弱碱反应 | D. | 稀的强酸和浓的弱碱反应 |
11.如图是一种航天器能量储存系统原理示意图.下列说法正确的是 ( )

| A. | 装置X能实现燃料电池的燃料和氧化剂再生 | |
| B. | 装置Y中负极的电极反应式为:O2+2H2O+4e-=4OH- | |
| C. | 装置X是原电池,装置Y是电解池 | |
| D. | 装置X、Y形成的子系统能实现物质的零排放,并能实现化学能与电能间的完全转化 |




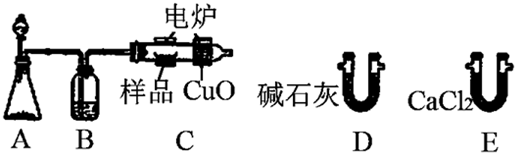
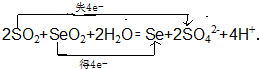 .
.