题目内容
2.浓H2SO4在使下列转化中,既表现出氧化性,又表现出酸性的是( )| A. | Cu→CuSO4 | B. | C→CO2 | C. | CuO→CuSO4 | D. | Fe2O3→Fe2(SO4)3 |
分析 浓H2SO4既表出现氧化性,又表现出酸性,则反应中S元素的化合价降低,且生成硫酸盐,以此来解答.
解答 解:A.生成二氧化硫,S元素的化合价降低,体现氧化性,且生成硫酸铜,体现酸性,故A正确;
B.反应中S元素的化合价都降低,只体现氧化性,故B错误;
C.反应中元素的化合价不变,生成硫酸铜,只体现酸性,故C错误;
D.反应中元素的化合价不变,生成硫酸铁,只体现酸性,故D错误.
故选A.
点评 本题考查氧化还原反应,为高频考点,侧重于学生的分析能力的考查,明确反应中元素的化合价变化为解答的关键,注意体现酸性应生成硫酸盐,题目难度不大.

练习册系列答案
 天天练口算系列答案
天天练口算系列答案
相关题目
19.废弃物的综合利用既有利于节约资源,又有利于保护环境.实验室利用废旧电池的铜帽(Cu、Zn 总含量约为99%)回收Cu并制备ZnO 的部分实验过程如下:
(1)铜帽溶解时加入H2O2 的目的是Cu+H2O2+H2SO4=CuSO4+2H2O(用化学方程式表示).铜帽溶解完全后,需将溶液中过量的H2O2 除去.除去H2O2 的简便方法是加热至沸.
(2)为确定加入锌灰(主要成分为Zn、ZnO,杂质为铁及其氧化物)的量,实验中需测定除去H2O2 后溶液中Cu2+的浓度.实验操作为:准确量取100mL含有Cu2+的溶液于烧杯中,取溶液20mL加水稀释至100mL,调节溶液pH=3~4,加入过量的KI,用0.1mol/L Na2S2O3标准溶液滴定至终点.上述过程中反应的离子方程式如下:2Cu2++4I-═2CuI(白色)↓+I2 2S2O32-+I2═2I-+S4O62-
①滴定选用的指示剂为淀粉溶液
②若滴定前溶液中的H2O2 没有除尽,所测定的Cu2+含量将会偏高(填“偏高”、“偏低”或“不变”).
③若滴定中消耗Na2S2O3标准溶液25mL,则原溶液中Cu2+物质的量浓度为0.125mol/L.
(3)已知pH>11 时Zn(OH)2 能溶于NaOH溶液生成ZnO22-.下表列出了几种离子生成氢氧化物沉淀的pH(开始沉淀的pH 按金属离子浓度为1.0mol•L-1计算).
实验中可选用的试剂:30%H2O2、1.0mol•L-1HNO3、1.0mol•L-1NaOH.
由除去铜的滤液制备ZnO 的实验步骤依次为:
①向滤液中加入30%H2O2,使其充分反应;②滴加1.0mol•L-1NaOH,调节溶液PH约为5(或3.2≤pH<5.9),使Fe3+沉淀完全;③过滤;④向滤液中滴加1.0mol•L-1NaOH,调节溶液PH约为10(或8.9≤pH≤11),使Zn2+沉淀完全;⑤过滤、洗涤、干燥;⑥900℃煅烧.

(1)铜帽溶解时加入H2O2 的目的是Cu+H2O2+H2SO4=CuSO4+2H2O(用化学方程式表示).铜帽溶解完全后,需将溶液中过量的H2O2 除去.除去H2O2 的简便方法是加热至沸.
(2)为确定加入锌灰(主要成分为Zn、ZnO,杂质为铁及其氧化物)的量,实验中需测定除去H2O2 后溶液中Cu2+的浓度.实验操作为:准确量取100mL含有Cu2+的溶液于烧杯中,取溶液20mL加水稀释至100mL,调节溶液pH=3~4,加入过量的KI,用0.1mol/L Na2S2O3标准溶液滴定至终点.上述过程中反应的离子方程式如下:2Cu2++4I-═2CuI(白色)↓+I2 2S2O32-+I2═2I-+S4O62-
①滴定选用的指示剂为淀粉溶液
②若滴定前溶液中的H2O2 没有除尽,所测定的Cu2+含量将会偏高(填“偏高”、“偏低”或“不变”).
③若滴定中消耗Na2S2O3标准溶液25mL,则原溶液中Cu2+物质的量浓度为0.125mol/L.
(3)已知pH>11 时Zn(OH)2 能溶于NaOH溶液生成ZnO22-.下表列出了几种离子生成氢氧化物沉淀的pH(开始沉淀的pH 按金属离子浓度为1.0mol•L-1计算).
| 开始沉淀的pH | 沉淀完全的pH | |
| Fe3+ | 1.1 | 3.2 |
| Fe2+ | 5.8 | 8.8 |
| Zn2+ | 5.9 | 8.9 |
由除去铜的滤液制备ZnO 的实验步骤依次为:
①向滤液中加入30%H2O2,使其充分反应;②滴加1.0mol•L-1NaOH,调节溶液PH约为5(或3.2≤pH<5.9),使Fe3+沉淀完全;③过滤;④向滤液中滴加1.0mol•L-1NaOH,调节溶液PH约为10(或8.9≤pH≤11),使Zn2+沉淀完全;⑤过滤、洗涤、干燥;⑥900℃煅烧.
20. 常温下,用0.1000mol•L-1的盐酸滴定20.00mL未知浓度的氨水,滴定曲线如图所示,滴加20.00mL盐酸时所得溶液中,c(Cl-)=c(NH4+)+c(NH3•H2O)+c(NH3),下列说法错误的是( )
常温下,用0.1000mol•L-1的盐酸滴定20.00mL未知浓度的氨水,滴定曲线如图所示,滴加20.00mL盐酸时所得溶液中,c(Cl-)=c(NH4+)+c(NH3•H2O)+c(NH3),下列说法错误的是( )
 常温下,用0.1000mol•L-1的盐酸滴定20.00mL未知浓度的氨水,滴定曲线如图所示,滴加20.00mL盐酸时所得溶液中,c(Cl-)=c(NH4+)+c(NH3•H2O)+c(NH3),下列说法错误的是( )
常温下,用0.1000mol•L-1的盐酸滴定20.00mL未知浓度的氨水,滴定曲线如图所示,滴加20.00mL盐酸时所得溶液中,c(Cl-)=c(NH4+)+c(NH3•H2O)+c(NH3),下列说法错误的是( )| A. | 该氨水的浓度0.1000mol•L-1 | |
| B. | 点①溶液中c(NH4+)+c(NH3•H2O)+c(NH3)=2c(Cl-) | |
| C. | 点②溶液中c(NH4+)=c(Cl-) | |
| D. | 点③溶液中c(Cl-)>c(H+)>c(NH4+)>c(OH-) |
10.下列各组物质充分反应后,只能得到一种气体的是( )
| A. | 木炭和浓硫酸共热 | B. | 过氧化钠与足量的稀硫酸反应 | ||
| C. | 足量的铜与一定量的浓硝酸反应 | D. | 足量的锌和定量的浓硫酸反应 |
17.短周期中的A、B、C、D、E五种元素,原子序数依次增大,A和D,C和E分别同主族,A为短周期元素中原子半径最小的元素,且A与B的原子序数之和等于C的原子序数,C2-与D+的核外电子数相等.则下列说法正确的是( )
| A. | B与A只能组成BA3化合物 | |
| B. | 第三周期中,D原子的原子半径最大 | |
| C. | A、B、C三元素不可能形成离子化合物 | |
| D. | E的氧化物对应水化物一定有强的氧化性 |
7.为体现“绿色奥运”“科技奥运”,2008年北京奥运会出现了中国自己生产的燃料电池汽车,作为马拉松领跑车和电视拍摄车,该车装着“绿色心脏”--质子交换膜燃料电池,下列叙述正确的是( )

| A. | 总反应式为:O2+2H2═2H2O | |
| B. | 正极的电极反应式为:O2+4H+═2H2O+4e- | |
| C. | 通入氧气的电极发生氧化反应 | |
| D. | 通入氢气的电极为正极 |
14.下列各组仪器常用于物质分离的是( )


| A. | ①③⑥ | B. | ②④⑥ | C. | ②③⑥ | D. | ②③⑤ |
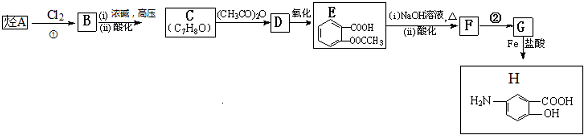
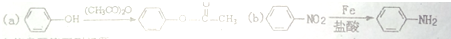
 ,F含有的官能团是羧基和酚羟基(填名称).
,F含有的官能团是羧基和酚羟基(填名称).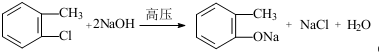 .
.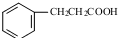 .
.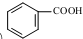 发生取代时,在羧基间位取代;②
发生取代时,在羧基间位取代;②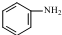 易发生氧化反应.以A为原料合成化合物
易发生氧化反应.以A为原料合成化合物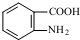 的设计合成路线为(其他试剂任选):
的设计合成路线为(其他试剂任选):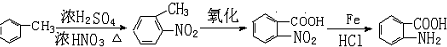 .
.
