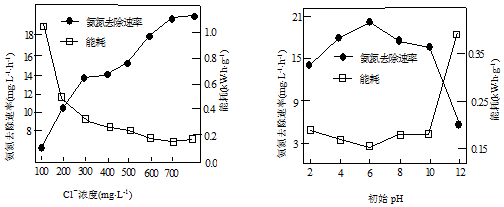
题目内容
4.图为①〜⑥六种烃分子的模型(小黑球代表碳原子,短线代表共价键,氢原子省略)下列说法中不正确的是( )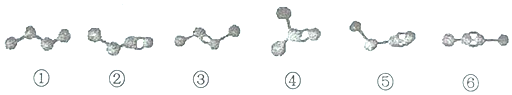
| A. | 烃②、③、④的分子式均为C4H8,三者互为同分异构体 | |
| B. | 烃⑤和⑥的分子式均为C4H6,二者互为同分异构体 | |
| C. | 烃②、③、⑤、⑥分别与足量氧气发生加成反应,均可得到烃① | |
| D. | 等物质的量的烃②和⑤分别在氧气中完全燃烧,烃⑤消耗的氧气多 |
分析 由球棍模型可知①为丁烷、②为1-丁烯、③为2-丁烯、④为2-甲基丙烯、⑤为1-丁炔、⑥为2-丁炔,结合对饮有机物的结构、性质解答该题.
解答 解:①为丁烷、②为1-丁烯、③为2-丁烯、④为2-甲基丙烯、⑤为1-丁炔、⑥为2-丁炔,
A.②为1-丁烯、③为2-丁烯、④为2-甲基丙烯,分子式均为C4H8,但结构不同,三者互为同分异构体,故A正确;
B.⑤为1-丁炔、⑥为2-丁炔,分子式均为C4H6,二者互为同分异构体,故B正确;
C.烃②、③含有碳碳双键,⑤、⑥含有碳碳三键,分别与足量氧气发生加成反应,均可得到烃①,故C正确;
D.②分子式为C4H8,⑤分子式为C4H6,分别在氧气中完全燃烧,烃②消耗的氧气多,故D错误.
故选D.
点评 本题考查有机物的结构与性质,为高频考点,侧重考查学生的分析能力,把握官能团与性质的关系为解答的关键,注意有机物的结构特点,题目难度不大.

练习册系列答案
相关题目
19.改变了“有机物就是有生命力的物质”观点的科学家是( )
| A. | 李比希 | B. | 维勒 | C. | 凯库勒 | D. | 诺贝尔 |
9. 短周期的四种元素位置如图所示,若四种元素的核电荷数之和为52,则与四种元素推断相关的描述不正确的是( )
短周期的四种元素位置如图所示,若四种元素的核电荷数之和为52,则与四种元素推断相关的描述不正确的是( )
 短周期的四种元素位置如图所示,若四种元素的核电荷数之和为52,则与四种元素推断相关的描述不正确的是( )
短周期的四种元素位置如图所示,若四种元素的核电荷数之和为52,则与四种元素推断相关的描述不正确的是( )| A. | A的最高价氧化物用于制作光导纤维 | |
| B. | B的最高价氧化物的水化物是一种强酸 | |
| C. | C至少有两种价态的氧化物 | |
| D. | D的一种单质是空气中含量最多的气体 |
13.用括号中的试剂除去各组物质中的杂质,可选试剂不正确的是( )
| A. | 乙醇中的水(新制CaO) | B. | 乙烷中乙烯(溴水) | ||
| C. | 苯中的甲苯(溴水) | D. | 乙酸乙酯中的乙酸(饱和Na2CO3溶液) |
14.X、Y为短周期元素,X位于IA族,X与Y可形成化合物X2Y,下列说法正确的是( )
| A. | X的原子半径一定大于Y的原子半径 | |
| B. | Y的离子半径一定大于X的离子半径 | |
| C. | X与Y的简单离子不可能具有相同的电子层结构 | |
| D. | 两元素形成的化合物中,原子个数比不可能为1:1 |