题目内容
12. 已知A、B、R、D都是周期表中前四周期的元素,它们的原子序数依次增大.其中A元素基态原子第一电离能比B元素基态原子的第一电离能大,B的基态原子的L层、R基态原子的M层均有2个单电子,D是第Ⅷ族中原子序数最小的元素.
已知A、B、R、D都是周期表中前四周期的元素,它们的原子序数依次增大.其中A元素基态原子第一电离能比B元素基态原子的第一电离能大,B的基态原子的L层、R基态原子的M层均有2个单电子,D是第Ⅷ族中原子序数最小的元素.(1)写出基态D原子的电子排布式[Ar]3d64s2.
(2)已知高纯度R的单质在现代信息技术与新能源开发中具有极为重要的地位.工业 上生产高纯度R的单质过程如下:
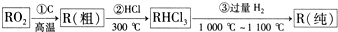
写出③的反应方程式SiHCl3+H2 $\frac{\underline{\;1000℃-1100℃\;}}{\;}$ Si+3HCl,已知RHCl3的沸点是31.5°C,则该物质的晶体类型是分子晶体,组成微粒的中心原子的轨道杂化类型为sp3,空间构型是四面体形.
(3)A的第一电离能比B的第一电离能大的原因是N原子的2p能级处于较稳定的半充满状态,A、B两元素分别与R形成的共价键中,极性较强的是Si-O.A、B两元素间能形成多种二元化合物,其中与A3-互为等电子体的物质的化学式为N2O.
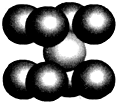
(4)已知D单质的晶胞如图所示,则晶体中D原子的配位数为8,一个D的晶胞质量为$\frac{112}{{N}_{A}}$g.
分析 B的基态原子的L层、R基态原子的M层均有2个单电子,则最外层电子数可能为4或6,B可能为C或O元素,R可能为Si或S元素,D是第Ⅷ族中原子序数最小的元素,应为Fe,A元素基态原子第一电离能比B元素基态原子的第一电离能大,且A的原子序数小于B,则A是N元素、B是O元素,高纯度R的单质在现代信息技术与新能源开发中具有极为重要的地位,则R是Si元素,
(1)D是Fe元素,其原子核外有26个电子,根据构造原理书写基态D原子的电子排布式;
(2)SiO2和C在高温下发生置换反应生成粗Si,粗硅和HCl在300℃条件下反应生成SiHCl3,SiHCl3和过量氢气在1000℃-1100℃条件下反应生成纯硅,
③的反应为SiHCl3和氢气的反应,生成Si和HCl,分子晶体熔沸点较低,该分子中Si原子价层电子对个数是4且不孤电子对,根据价层电子对互斥理论判断Si原子的轨道杂化类型及空间构型;
(3)原子轨道中电子处于全满、全空或半满最稳定;N、O两元素分别与Si形成的共价键中,元素的非金属性越强,其形成的化合物中极性键的极性越强;等电子体中原子个数相等及价电子数相等;
(4)该晶胞是体心立方晶胞,该晶胞中Fe原子个数=1+8×$\frac{1}{8}$=2,其配合物是8,每个Fe原子的质量=$\frac{M}{{N}_{A}}$,则该晶胞质量就是两个Fe原子质量.
解答 解:B的基态原子的L层、R基态原子的M层均有2个单电子,则最外层电子数可能为4或6,B可能为C或O元素,R可能为Si或S元素,D是第Ⅷ族中原子序数最小的元素,应为Fe,A元素基态原子第一电离能比B元素基态原子的第一电离能大,且A的原子序数小于B,则A是N元素、B是O元素,高纯度R的单质在现代信息技术与新能源开发中具有极为重要的地位,则R是Si元素,
(1)D是Fe元素,其原子核外有26个电子,根据构造原理书写基态D原子的电子排布式为[Ar]3d64s2,
故答案为:[Ar]3d64s2;
(2)SiO2和C在高温下发生置换反应生成粗Si,粗硅和HCl在300℃条件下反应生成SiHCl3,SiHCl3和过量氢气在1000℃-1100℃条件下反应生成纯硅,
③的反应为SiHCl3和氢气的反应,生成Si和HCl,反应方程式为SiHCl3+H2 $\frac{\underline{\;1000℃-1100℃\;}}{\;}$ Si+3HCl;
分子晶体熔沸点较低,该物质熔沸点较低,为分子晶体,该分子中Si原子价层电子对个数是4且不孤电子对,根据价层电子对互斥理论判断Si原子的轨道杂化类型及空间构型分别为sp3、四面体形,
故答案为:SiHCl3+H2 $\frac{\underline{\;1000℃-1100℃\;}}{\;}$ Si+3HCl;分子晶体;sp3;四面体形;
(3)原子轨道中电子处于全满、全空或半满最稳定,N原子的2p能级处于较稳定的半充满状态,所以N原子比O原子第一电离能大;N、O两元素分别与Si形成的共价键中,元素的非金属性越强,其形成的化合物中极性键的极性越强,因为O元素的非金属性大于N,则极性O-Si键>N-Si键;等电子体中原子个数相等及价电子数相等,N3-中含有3个原子、价电子数是16,与该离子互为等电子体的氮氧化物为N2O,
故答案为:N原子的2p能级处于较稳定的半充满状态;O-Si键;N2O;
(4)该晶胞是体心立方晶胞,该晶胞中Fe原子个数=1+8×$\frac{1}{8}$=2,体心上的Fe原子被顶点上的8个原子包围,所以其配合物是8,每个Fe原子的质量=$\frac{M}{{N}_{A}}$g,则该晶胞质量就是两个Fe原子质量=2×$\frac{M}{{N}_{A}}$g=2×$\frac{56}{{N}_{A}}$g=$\frac{112}{{N}_{A}}$g,
故答案为:$\frac{112}{{N}_{A}}$g.
点评 本题考查物质结构和性质,为高频考点,涉及晶胞计算、等电子体判断、原子结构、微粒空间构型判断等知识点,侧重考查学生分析判断计算能力,注意(2)中SiHCl3是四面体而不是正四面体结构,应为Si-H、Si-Cl不同导致的,为易错点.

| A. | 油脂水解可得到氨基酸 | |
| B. | 蛋白质水解可以得到高级脂肪酸 | |
| C. | 维生素是一类高分子化合物 | |
| D. | 淀粉和纤维素的组成的化学式可表示为(C6H10O5)n,水解最终产物都是葡萄糖 |
| A. | 15mol•L-1 | B. | 10mol•L-1 | C. | 5mol•L-1 | D. | 1mol•L-1 |
已知:CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H=-283.0kJ/mol
S(g)+O2(g)=SO2(g)△H=-296.0kJ/mol
下列说法不正确的是( )
| A. | 两个反应均为氧化还原反应 | |
| B. | CO2与SO2不能用澄清石灰水鉴别 | |
| C. | CO2分子中各原子最外层均为8电子稳定结构 | |
| D. | 相同条件下:2CO(g)+SO2(g)=S(g)+2CO2(g)△H=+270kJ/mol |
| A. | 温室效应 | B. | 氮的氧化物排放 | C. | 白色污染 | D. | 对臭氧层的破坏 |