题目内容
10.下列关于平衡常数说法正确的是( )| A. | 增大反应物的浓度,平衡常数K增大 | B. | 加大体系压强,平衡常数K增大 | ||
| C. | 加入负催化剂,平衡常数K减小 | D. | 升高温度,平衡常数K发生变化 |
分析 化学平衡常数是用生成物浓度系数次幂之积除以反应物浓度系数次幂之积,化学平衡常数的大小只受温度的影响,以此解答该题.
解答 解:平衡常数只受温度的影响,与浓度、压强、催化剂无关,升高温度,平衡向吸热反应向移动,则平衡常数增大,
故选D.
点评 本题考查化学平衡常数的含义,为高频考点,侧重于学生的分析能力的考查,注意把握平衡常数的含义,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
18.可逆反应2A(s)?C(g)+D(g)正向建立平衡后,维持其它条件不变,压缩容器的体积,下列说法正确的是( )
| A. | 正逆反应速率都增大 | |
| B. | 平衡不移动 | |
| C. | 再次平衡时c(D) 不变 | |
| D. | C的体积分数不再变化说明再次达到平衡 |
5.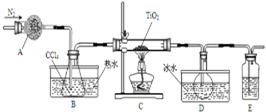 实验室利用反应TiO2(s)+CCl4(g)$\frac{\underline{\;\;△\;\;}}{\;}$TiCl4(g)+CO2(g),在无水无氧条件下制备TiCl4,实验装置示意图如下,有关物质性质如表.
实验室利用反应TiO2(s)+CCl4(g)$\frac{\underline{\;\;△\;\;}}{\;}$TiCl4(g)+CO2(g),在无水无氧条件下制备TiCl4,实验装置示意图如下,有关物质性质如表.
(1)仪器A的名称是干燥管,装置E中的试剂是浓硫酸.反应开始前依次进行如下操作:组装仪器、检验气密性、加装药品、通N2一段时间后点燃酒精灯.
(2)反应结束后的操作包括:a停止通N2 b熄灭酒精灯 c冷却至室温.正确的顺序为bca(填序号).选择这种顺序的理由是防止倒吸或避免生成的产物在受热情况下与氧气反应(二者任写其一均给分);欲分离D中的液态混合物,所采用操作的名称是蒸馏.
 实验室利用反应TiO2(s)+CCl4(g)$\frac{\underline{\;\;△\;\;}}{\;}$TiCl4(g)+CO2(g),在无水无氧条件下制备TiCl4,实验装置示意图如下,有关物质性质如表.
实验室利用反应TiO2(s)+CCl4(g)$\frac{\underline{\;\;△\;\;}}{\;}$TiCl4(g)+CO2(g),在无水无氧条件下制备TiCl4,实验装置示意图如下,有关物质性质如表.| 物质 | 熔点/℃ | 沸点/℃ | 其他 |
| CCl4 | -23 | 76 | 与TiCl4互溶 |
| TiCl4 | -25 | 136 | 遇潮湿空气产白雾 |
(2)反应结束后的操作包括:a停止通N2 b熄灭酒精灯 c冷却至室温.正确的顺序为bca(填序号).选择这种顺序的理由是防止倒吸或避免生成的产物在受热情况下与氧气反应(二者任写其一均给分);欲分离D中的液态混合物,所采用操作的名称是蒸馏.
15.下列关于化学反应速率的说法正确的是( )
| A. | 对于任何化学反应来说,反应速率越大,反应现象越明显 | |
| B. | 化学反应速率为“0.8mol/(L•min)”表示的意思是:时间为1s时,某物质的浓度为0.8mol/L | |
| C. | 化学反应达到平衡状态,反应停止 | |
| D. | 化学反应速率是定量描述化学反应快慢的物理量 |
2.在温度t1和t2(t2>t1)下,X2(g)和H2反应生成HX的平衡常数如下表:
下列说法不正确的是( )
| 化学方程式 | K(t1) | K(t2) | |
| ① | Br2 (g)+H2(g)?2HBr(g) | 5.6×107 | 9.3×106 |
| ② | I2 (g)+H2 (g)?2HI(g) | 43 | 34 |
| A. | ①和②均是放热反应 | |
| B. | 相同条件下,平衡体系中HX所占的比例:①>② | |
| C. | 其他条件不变时,增大压强可提高X2的平衡转化率 | |
| D. | 其他条件不变时,升高温度可加快HX的生成速率 |
19.下列推断正确的是( )
| A. | 由H+(aq)+OH- (aq)=H2O(l)△H=-57.3 kJ•mol-1:可知含1 mol氢氧化钡的溶液与含0.5 mol硫酸的稀溶液混合,放出热量大于57.3 kJ | |
| B. | 由H2O(g)=H2O(l)△H=-44.0kJ•mol-1可知是放热反应; | |
| C. | 由SO2(g)+$\frac{1}{2}$O2(g)?SO3(g)△H=-98.3 kJ•mol-1可知,在密闭容器中充入2 mol SO2和1 mol O2充分反应后,放出热量为196.6 kJ | |
| D. | 氢气的燃烧热(△H)为-285.5kJ/mo1,则水电解的热化学方程式为:2H2O(1)=2H2(g)+O2(g)△H=+285.5KJ/mo1 |
20.有关键能数据如表:
晶体硅在氧气中燃烧的热化学方程式:Si(s)+O2(g)═SiO2(s)△H=-989.2kJ•mol-1,则表中X的值为( )
| 化学键 | Si-O | O=O | Si-Si |
| 键能kJ•mol-1 | 460 | 498.8 | X |
| A. | 423.3 | B. | 352 | C. | 920 | D. | 176 |
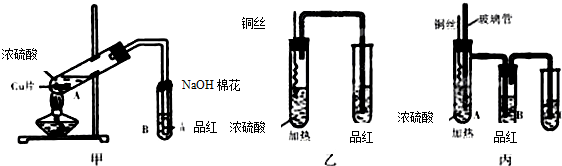
 某化学兴趣小组按如图所示装置探究铜与浓硫酸反应.随着温度的升高,有白雾产生,最终发现铜表面变黑,并有细小黑色颗粒物生成;试管B中有白色沉淀生成.
某化学兴趣小组按如图所示装置探究铜与浓硫酸反应.随着温度的升高,有白雾产生,最终发现铜表面变黑,并有细小黑色颗粒物生成;试管B中有白色沉淀生成.