题目内容
19.下列推断正确的是( )| A. | 由H+(aq)+OH- (aq)=H2O(l)△H=-57.3 kJ•mol-1:可知含1 mol氢氧化钡的溶液与含0.5 mol硫酸的稀溶液混合,放出热量大于57.3 kJ | |
| B. | 由H2O(g)=H2O(l)△H=-44.0kJ•mol-1可知是放热反应; | |
| C. | 由SO2(g)+$\frac{1}{2}$O2(g)?SO3(g)△H=-98.3 kJ•mol-1可知,在密闭容器中充入2 mol SO2和1 mol O2充分反应后,放出热量为196.6 kJ | |
| D. | 氢气的燃烧热(△H)为-285.5kJ/mo1,则水电解的热化学方程式为:2H2O(1)=2H2(g)+O2(g)△H=+285.5KJ/mo1 |
分析 A.氢氧化钡和硫酸反应生成水的同时生成硫酸钡沉淀;
B.H2O(g)=H2O(l)为物理变化;
C.为可逆反应;
D.吸收热量数值错误.
解答 解:A.硫酸根与钡离子反应生成硫酸钡沉淀也会放热,所以放出热量大于57.3 kJ,故A正确;
B.H2O(g)=H2O(l)为物理变化,而吸热反应、放热反应只针对化学变化,故B错误;
C.反应为可逆反应,2 mol SO2和1 mol O2不可能完全反应,放出热量少于196.6 kJ,故C错误;
D.氢气的燃烧热(△H)为-285.5kJ/mo1,则水电解的热化学方程式为:2H2O(1)=2H2(g)+O2(g)△H=+571KJ/mo1,故D错误.
故选A.
点评 本题综合考查化学反应与能量变化,为高考常见题型,侧重于学生的分析能力以及双基的考查,注意把握中和热、反应热等相关概念以及可逆反应的特点,为易错点,难度不大.

练习册系列答案
相关题目
10.下列关于平衡常数说法正确的是( )
| A. | 增大反应物的浓度,平衡常数K增大 | B. | 加大体系压强,平衡常数K增大 | ||
| C. | 加入负催化剂,平衡常数K减小 | D. | 升高温度,平衡常数K发生变化 |
7.乙酸异戊酯是组成蜜蜂信息素的成分之一,具有香蕉的香味,实验室用乙酸和异戊醇制备乙酸异戊酯的反应、装置示意图和有关数据如下:
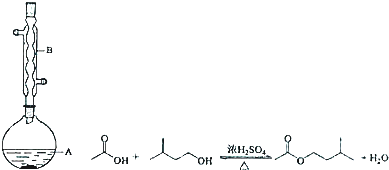
实验步骤:
在A中加入4.4g的异戊醇,6.0g的乙酸、数滴浓硫酸和2〜3片碎瓷片,开始缓慢加热A,回流50min,反应液冷至室温后,倒入分液漏斗中,分别用少量水,饱和碳酸氢钠溶液和水洗涤,分出的产物加入少量无水MgSO4,固体,静置片刻,过滤除去MgS04固体,进行蒸馏纯化,收集140〜143℃馏分,得乙酸异戊酯3.9g.
回答下列问题:
(1)装置B的名称是冷凝管或球形冷凝管,作用是冷凝回流,使反应物充分利用.
(2)碎瓷片的作用是防暴沸.
(3)在洗涤操作中,第一次水洗的主要目的是洗掉大部分硫酸和醋酸,第二次水洗的主要目的是洗掉碳酸氢钠等盐.
(4)在洗涤、分液操作中,应充分振荡,然后静置,待分层后d
a.直接将乙酸异戊酯从分液漏斗上口倒出
b.直接将乙酸异戊酯从分液漏斗下口放出
c.先将水层从分液漏斗的下口放出,再将乙酸异戊酯从下口放出
d.先将水层从分液漏斗的下口放出,再将乙酸异戊酯从上口倒出
(5)实验中加入少量无水MgS04的目的是干燥乙酸异戊酯.
(6)本实验的产率是d.
a.30% b.40% c.50% d.60%

| 相对分子质量 | 密度/(g•cm-3) | 沸点/℃ | 水中溶解性 | |
| 异戍醇 | 88 | 0.8123 | 131 | 微溶 |
| 乙酸 | 60 | 1.0492 | 118 | 溶 |
| 乙酸异戊酯 | 130 | 0.8670 | 142 | 难溶 |
在A中加入4.4g的异戊醇,6.0g的乙酸、数滴浓硫酸和2〜3片碎瓷片,开始缓慢加热A,回流50min,反应液冷至室温后,倒入分液漏斗中,分别用少量水,饱和碳酸氢钠溶液和水洗涤,分出的产物加入少量无水MgSO4,固体,静置片刻,过滤除去MgS04固体,进行蒸馏纯化,收集140〜143℃馏分,得乙酸异戊酯3.9g.
回答下列问题:
(1)装置B的名称是冷凝管或球形冷凝管,作用是冷凝回流,使反应物充分利用.
(2)碎瓷片的作用是防暴沸.
(3)在洗涤操作中,第一次水洗的主要目的是洗掉大部分硫酸和醋酸,第二次水洗的主要目的是洗掉碳酸氢钠等盐.
(4)在洗涤、分液操作中,应充分振荡,然后静置,待分层后d
a.直接将乙酸异戊酯从分液漏斗上口倒出
b.直接将乙酸异戊酯从分液漏斗下口放出
c.先将水层从分液漏斗的下口放出,再将乙酸异戊酯从下口放出
d.先将水层从分液漏斗的下口放出,再将乙酸异戊酯从上口倒出
(5)实验中加入少量无水MgS04的目的是干燥乙酸异戊酯.
(6)本实验的产率是d.
a.30% b.40% c.50% d.60%
4.某化学小组想探究铁与浓硫酸能否反应产生气体,进行了如下实验:
【实验】甲同学在烧瓶中加入足量的铁丝与浓H2SO4溶液,开始无明显变化,对反应物加热,有气泡产生可收集到无色气体.
【查阅资料】①铁与浓硫酸在常温下会发生钝化,看不到明显现象,加热情况下会反应,产生有刺激性气味的二氧化硫气体;
②二氧化硫气体能使品红溶液褪色,能被氢氧化钠溶液吸收.
【提出假设】甲同学认为收集到的就是二氧化硫气体,乙同学认为还有氢气,你认为乙同学预测有氢气的理由是:随着反应的进行,浓硫酸会变稀,Fe会与稀硫酸反应产生氢气.
气体的组成可能有以下几种情况:
假设一:无色气体是SO2;
假设二:无色气体是H2;
假设三:无色气体是SO2 与H2 的混合气体.
【实验验证】请你设计实验验证上述假设三,完成下表中内容.小组同学在实验室找到可能在实验探究过程中能用到的试剂有:品红溶液、NaOH溶液、火柴、CuO粉末、无水硫酸铜,仪器任选.
【实验】甲同学在烧瓶中加入足量的铁丝与浓H2SO4溶液,开始无明显变化,对反应物加热,有气泡产生可收集到无色气体.
【查阅资料】①铁与浓硫酸在常温下会发生钝化,看不到明显现象,加热情况下会反应,产生有刺激性气味的二氧化硫气体;
②二氧化硫气体能使品红溶液褪色,能被氢氧化钠溶液吸收.
【提出假设】甲同学认为收集到的就是二氧化硫气体,乙同学认为还有氢气,你认为乙同学预测有氢气的理由是:随着反应的进行,浓硫酸会变稀,Fe会与稀硫酸反应产生氢气.
气体的组成可能有以下几种情况:
假设一:无色气体是SO2;
假设二:无色气体是H2;
假设三:无色气体是SO2 与H2 的混合气体.
【实验验证】请你设计实验验证上述假设三,完成下表中内容.小组同学在实验室找到可能在实验探究过程中能用到的试剂有:品红溶液、NaOH溶液、火柴、CuO粉末、无水硫酸铜,仪器任选.
| 实验方案与步骤 | 实验现象和结论 |
| 1.将少量气体通入盛有少量品红溶液的试管内; | 若品红溶液褪色,则无色气体中有SO2. |
| 2.将气体通过装有足量氢氧化钠溶液的洗气瓶后,用小试管收集气体,并在酒精灯上点燃 | 若收集到气体可以燃烧,则无色气体中有H2. 结合以上实验可知假设三成立. |
11.下列说法正确的是( )
| A. | 化学反应都伴随着热量的变化 | |
| B. | 个别化学反应与能量变化无关 | |
| C. | 某些吸热反应在不加热条件下也能发生 | |
| D. | 放热反应的发生无需任何条件 |
8.已知:4HCl(g)+O2 (g)?12C12 (g)+2H2O(g)△H=-123kJ.mol-1.其中相关的化学键键能数据如下:
其中a值为( )
| 化学键 | H-Cl | O═O | Cl-Cl | H-O |
| E/(kJ•mol-1) | 431 | 397 | a | 465 |
| A. | 242 | B. | 303.5 | C. | 180.5 | D. | 365 |
9.下列图示实验正确的是( )
| A. |  除去粗盐溶液中不溶物 | B. |  碳酸氢钠受热分解 | ||
| C. |  制取少量Cl2 | D. |  稀硝酸与铜的反应制取并收集NO |

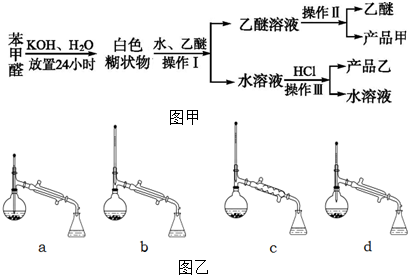
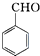 +KOH→
+KOH→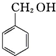 +
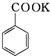
+
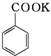 +HCl→
+HCl→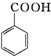 +KCl
+KCl