题目内容
14.下列有关叙述正确的是( )| A. | 稀硝酸和氢氧化亚铁反应的离子方程式:Fe(OH)2+2H+═Fe2++2H2O | |
| B. | 少量SO2通入Ca(ClO)2溶液中:SO2+H2O+Ca2++2ClO-═CaSO3↓+2HClO | |
| C. | 在酸性溶液中,Na+、K+、MnO4-、Br-能大量共存 | |
| D. | 除去Mg2+溶液中的少量Al3+,可以采用加入足量的氢氧化钠后过滤、再加酸的方法 |
分析 A.发生氧化还原反应生成硝酸铁、NO和水;
B.发生氧化还原反应生成硫酸钙;
C.离子之间发生氧化还原反应;
D.氢氧化铝具有两性,而氢氧化镁不溶于NaOH.
解答 解:A.氢氧化亚铁与稀硝酸混合的离子反应为3Fe(OH)2+NO3-+10H+=3Fe3++8H2O+NO↑,故A错误;
B.向Ca(ClO)2溶液中通入少量SO2,二氧化硫具有还原性,被次氯酸根离子氧化,离子方程式为Ca2++2ClO-+SO2+H2O=CaSO4+H++Cl-+HClO,故B错误;
C.H+、MnO4-、Br-发生氧化还原反应,不能大量共存,故C错误;
D.氢氧化铝具有两性,而氢氧化镁不溶于NaOH,则除去Mg2+溶液中的少量Al3+,可以采用加入足量的氢氧化钠后过滤、再加酸的方法,故D正确;
故选D.
点评 本题考查离子反应方程式书写的正误判断,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重复分解反应、氧化还原反应的离子共存考查,注意离子反应中保留化学式的物质及电子、电荷守恒,题目难度不大.

练习册系列答案
 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案
相关题目
9.25℃时,在pH=1的溶液中可以大量共存的离子组是( )
| A. | K+、Na+、HCO3-、NO3- | B. | Na+、K+、SO42-、Cl- | ||
| C. | Ba2+、Mg2+、SO42-、NO3- | D. | Fe2+、K+、NO3-、Na+ |
19.下列有关说法正确的是( )
| A. | 催化剂可以加快化学反应速率,也能增大化学反应的焓变 | |
| B. | 常温下,pH均为5的盐酸与氯化铵溶液中,水的电离程度相同 | |
| C. | 25℃下,在NH3•H2O稀溶液中加水稀释,$\frac{c({H}^{+})•c(N{H}_{3}•{H}_{2}O)}{c(N{{H}_{4}}^{+})}$的值不变 | |
| D. | 在NaHS溶液中,滴入少量CuCl2溶液产生黑色沉淀,HS-电离程度减小 |
6.对如图装置(铁的防护)的分析正确的是( )
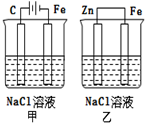

| A. | 甲装置是牺牲阳极的阴极保护法 | |
| B. | 乙装置是牺牲阳极的阴极保护法 | |
| C. | 一段时间后甲、乙装置中pH均增大 | |
| D. | 甲、乙装置中铁电极的电极反应式均为:2H++2e→H2↑ |
2.下列化学反应的离子方程式正确的是( )
| A. | 在NaAlO2溶液中通入过量CO2:AlO2-+4CO2+2H2O═Al3++4HCO3- | |
| B. | Ca(ClO)2溶液中通入少量CO2:CO2+H2O+Ca2++2ClO-═CaCO3↓+2HClO | |
| C. | 用Fe(NO3)2溶液加入HCl溶液:Fe2++NO3-+4H+═Fe3++NO↑+2H2O | |
| D. | FeBr2溶液通入少量的Cl2:2Fe2++2Br-+2Cl2═2Fe3++Br2+4Cl- |
3.化学与生活、环境密切相关,下列说法错误的是( )
| A. | 生活中钢铁制品生锈主要是由于吸氧腐蚀所致 | |
| B. | 乙烯可作为水果的催熟剂 | |
| C. | 葡萄糖、油脂、蛋白质等进入人体内经水解后被吸收 | |
| D. | 使用漂白液时不可与酸性洁厕剂混用 |
 -l Na
-l Na OH 溶液等体积混合后:
OH 溶液等体积混合后: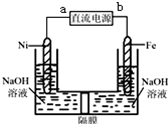 Na2FeO4是一种既能杀菌、消毒,又能絮凝净水的水处理剂,其电解制法如图所示,请根据图示分析:电解过程中的电池反应为Fe+2OH-+2H2O $\frac{\underline{\;电解\;}}{\;}$FeO42-+3H2↑;每转移0.6mol电子在Ni电极上产生的气体在标况下的体积为6.72L;隔膜用阳离子交换膜(只允许阳离子通过)还是阴离子交换膜(只允许阴离子通过)阳离子交换膜.
Na2FeO4是一种既能杀菌、消毒,又能絮凝净水的水处理剂,其电解制法如图所示,请根据图示分析:电解过程中的电池反应为Fe+2OH-+2H2O $\frac{\underline{\;电解\;}}{\;}$FeO42-+3H2↑;每转移0.6mol电子在Ni电极上产生的气体在标况下的体积为6.72L;隔膜用阳离子交换膜(只允许阳离子通过)还是阴离子交换膜(只允许阴离子通过)阳离子交换膜.