题目内容
10.工业上由CO2和NH3合成尿素(2NH3+CO2═CO(NH2)2+H2O ).
(1)当$\frac{n(N{H}_{3})}{n(C{O}_{2})}$=2,CO2的转化率随时间的变化关系如图1所示.则NH3的平衡转化率为40%.
(2)用如图2所示装置电解尿素和KOH的混合液制取氢气时,a、b均为惰性电极,隔膜仅仅起阻止气体通过的作用,写出a电极的电极反应式CO(NH2)2-6e-+8OH-=CO32-+N2↑+4H2O.若电解过程中发生了6mol电子的转移,则消耗尿素60g,得到标准状况下的氢气67.2L.
分析 (1)二氧化碳的量计算参加反应的氨气的量,假设充入氨气、二氧化碳的物质的量分别是2mol、1mol,达到平衡时,反应的n(CO2)=1mol×0.4=0.4mol,则反应的n(NH3)=2n(CO2)=0.8mol,再结合转化率公式计算;
(2)由阳极排出液中含有大量的碳酸盐成份,则尿素在阳极参与反应,N元素的化合价升高,以此来书写阳极电极反应;由图可知,阴极生成氢气以此来书写阴极电极反应,结合电子守恒计算消耗的尿素和生成的气体.
解答 解:(1)假设充入氨气、二氧化碳的物质的量分别是2mol、1mol,达到平衡时,反应的n(CO2)=1mol×0.4=0.4mol,则反应的n(NH3)=2n(CO2)=0.8mol,氨气的转化率=$\frac{0.8mol}{2mol}$×100%=40%,
故答案为:40%;
(2)由阳极排出液中含有大量的碳酸盐成份,尿素在阳极参与反应,则阳极反应式为:CO(NH2)2+8OH-+6e-═CO32-+N2↑+6H2O,由图可知,阴极生成氢气,则阴极反应为:6H2O-6e-═3H2↑+6OH-,电子守恒分析可知,电解过程中发生了6mol电子的转移消耗尿素1mol,质量=1mol×60g/mol=60g,得到标准状况下的氢气3mol,标准状况下气体体积=3mol×22.4L/mol=67.2L,
故答案为:CO(NH2)2+8OH-+6e-═CO32-+N2↑+6H2O;60;67.2.
点评 本题主要考查了化学平衡的计算、原电池的工作原理,学生应学会利用习题中的信息结合所学的知识来解答,题目难度不大,注意对高考热点的训练.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
11.关于物质的类别,下列说法正确的是( )
| A. | 食盐水、糖水和冰水都是饮料,属于混合物 | |
| B. | O2不能导电,故O2是非电解质 | |
| C. | 烧碱属于碱,纯碱属于盐 | |
| D. | NaHSO4能电离出氢离子,故NaHSO4属于酸 |
12.反应4NH3+5O2$\frac{\underline{\;催化剂\;}}{△}$4NO+6H2O是工业制硝酸的重要一步,有关该反应的说法正确的是( )
| A. | NH3被氧化 | B. | NH3是氧化剂 | C. | NO是还原产物 | D. | H2O是氧化产物 |
9.同温同压下,2体积某气体分解成1体积X2气体与3体积Y2气体,则该化合物的化学式为( )
| A. | XY | B. | X3Y | C. | XY3 | D. | X2Y3 |
2.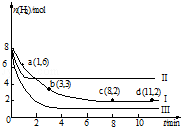 一定温度下,向容积为2L的恒容密闭容器中充入6mol CO2和8mol H2,发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ•mol-1,测得n(H2)随时间变化如曲线Ⅰ所示.下列说法正确的是( )
一定温度下,向容积为2L的恒容密闭容器中充入6mol CO2和8mol H2,发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ•mol-1,测得n(H2)随时间变化如曲线Ⅰ所示.下列说法正确的是( )
 一定温度下,向容积为2L的恒容密闭容器中充入6mol CO2和8mol H2,发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ•mol-1,测得n(H2)随时间变化如曲线Ⅰ所示.下列说法正确的是( )
一定温度下,向容积为2L的恒容密闭容器中充入6mol CO2和8mol H2,发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ•mol-1,测得n(H2)随时间变化如曲线Ⅰ所示.下列说法正确的是( )| A. | 该反应在0~8 min内CO2的平均反应速率是 0.375 mol•L-1•min-1 | |
| B. | 若起始时向上述容器中充入3 mol CO2和4 mol H2,则平衡时H2的体积分数大于20% | |
| C. | 若起始时向上述容器中充入4 mol CO2、2 mol H2、2 mol CH3OH和1mol H2O(g),则此时反应向正反应方向进行 | |
| D. | 改变条件得到曲线Ⅱ、Ⅲ,则曲线Ⅱ、Ⅲ改变的条件分别是升高温度、充入氦气 |

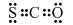 ;生成CO(g)与Sx(s)反应的热化学方程式是xCOS(g)=xCO(g)+Sx(s)△H=0.5x(b-a)kJ/mol
;生成CO(g)与Sx(s)反应的热化学方程式是xCOS(g)=xCO(g)+Sx(s)△H=0.5x(b-a)kJ/mol
 SO2和NOx在化学工业上有重要用途,也是大气污染的主要来源,开发和利用并重,预防和治理并举是当前工业上和环境保护领域研究的主要课题之一.
SO2和NOx在化学工业上有重要用途,也是大气污染的主要来源,开发和利用并重,预防和治理并举是当前工业上和环境保护领域研究的主要课题之一.