题目内容
5.已知25℃时,Ksp[Cu(OH)2]=2×10-20.(1)某CuSO4溶液里c(Cu2+)=0.02mol/L,如要生成Cu(OH)2沉淀,应调整溶液的pH,
使之大于5.
(2)要使0.2mol•L-1 CuSO4溶液中Cu2+沉淀较为完全(使Cu2+浓度降至原来的千分之一),则应向溶液里加入NaOH溶液,使溶液的pH为6.
分析 (1)如生成沉淀,应满足c(Cu2+)×c2(OH-)>2×10-20,c(Cu2+)=0.02mol/L,可计算c(OH-),进而计算pH;
(2)使0.2mol•L-1 CuSO4溶液中Cu2+沉淀较为完全(使Cu2+浓度降至原来的千分之一),则c(Cu2+)=2×10-5mol/L,以此计算pH.
解答 解:(1)如生成沉淀,应满足c(Cu2+)×c2(OH-)>2×10-20,c(Cu2+)=0.02mol/L,则c(OH-)=$\sqrt{\frac{2×1{0}^{-20}}{0.02}}$mol/L=10-9mol/L,则c(H+)=10-5mol/L,pH=5,
故答案为:5;
(2)使0.2mol•L-1 CuSO4溶液中Cu2+沉淀较为完全(使Cu2+浓度降至原来的千分之一),则c(Cu2+)=2×10-4mol/L,则c(OH-)=$\sqrt{\frac{2×1{0}^{-20}}{2×1{0}^{-4}}}$mol/L=10-6mol/L,则c(H+)=10-6mol/L,pH=6,故答案为:6.
点评 本题考查溶度积常数的计算,为高频考点,侧重于学生的分析能力和计算能力的考查,题目难度不大,注意把握计算公式的运用.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
7.在无色透明的水溶液中能大量共存的一组离子是( )
| A. | Na+、Ag+、Cl-、CO32- | B. | H+、Na+、Fe2+、MnO4- | ||
| C. | K+、Ca2+、Cl-、NO3- | D. | K+、NH4+、OH-、SO42- |
4.某气体可能含有CO、CO2、H2、HCl和水蒸气中的一种或几种,依次通过硝酸银溶液(有浑浊现象)、氢氧化钠溶液(有浑浊现象)、浓硫酸、灼热的氧化铜(变红)和无水CuSO4(变蓝),判断该气体中一定有( )
| A. | HCl、CO2、CO | B. | CO、H2、H2O | C. | HCl、CO2、H2 | D. | HCl、CO2、H2 |
11.下列有关中和滴定的部分操作顺序正确的是( )
①标准溶液润洗滴定管 ②往滴定管中注入标准溶液 ③检查滴定管是否漏水 ④滴定 ⑤洗涤滴定管 ⑥调整滴定管中液面在“0”或“0”以下刻度 ⑦记数.
①标准溶液润洗滴定管 ②往滴定管中注入标准溶液 ③检查滴定管是否漏水 ④滴定 ⑤洗涤滴定管 ⑥调整滴定管中液面在“0”或“0”以下刻度 ⑦记数.
| A. | ⑤①②③④⑥⑦ | B. | ③⑤①②⑥⑦④ | C. | ③⑤②⑦①⑥④ | D. | ②⑥⑦①③⑤④ |
17.甲醇是一种可再生能源,具有广泛的开发和应用前景.
(1)工业上一般采用下列两种反应合成甲醇:
反应Ⅰ:CO(g)+2H2(g)??CH3OH(g)△H1
反应Ⅱ:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H2
①上述反应符合“原子经济”原则的是I(填“Ⅰ”或“Ⅱ”).
②下表所列数据是反应Ⅰ在不同温度下的化学平衡常数(K).
由表中数据判断,△H1<0(填“>”、“=”或“<”).
③某温度下,将1mol CO和3mol H2充入1L的密闭容器中,充分反应,达到平衡后,
测得c(CO)=0.2mol•L-1,则CO的转化率为80%,此时的温度为250℃(从上表中选择).
(2)已知在常温常压下:
①2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(g)△H1=-1 275.6kJ•mol-1
②2CO(g)+O2(g)═2CO2(g)△H2=-566.0kJ•mol-1
③H2O(g)═H2O(l)△H3=-44.0kJ•mol-1
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:CH3OH(l)+O2(g)═CO(g)+2H2O(l)△H=-442.8kJ•mol-1.
(1)工业上一般采用下列两种反应合成甲醇:
反应Ⅰ:CO(g)+2H2(g)??CH3OH(g)△H1
反应Ⅱ:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H2
①上述反应符合“原子经济”原则的是I(填“Ⅰ”或“Ⅱ”).
②下表所列数据是反应Ⅰ在不同温度下的化学平衡常数(K).
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
③某温度下,将1mol CO和3mol H2充入1L的密闭容器中,充分反应,达到平衡后,
测得c(CO)=0.2mol•L-1,则CO的转化率为80%,此时的温度为250℃(从上表中选择).
(2)已知在常温常压下:
①2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(g)△H1=-1 275.6kJ•mol-1
②2CO(g)+O2(g)═2CO2(g)△H2=-566.0kJ•mol-1
③H2O(g)═H2O(l)△H3=-44.0kJ•mol-1
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:CH3OH(l)+O2(g)═CO(g)+2H2O(l)△H=-442.8kJ•mol-1.
15.下列说法正确的是( )
| A. | 物质的溶解性为难溶,则该物质的溶解度为0 | |
| B. | 某离子被沉淀完全是指该离子在溶液中的浓度为0 | |
| C. | 通过沉淀反应能将大部分杂质离子沉淀 | |
| D. | 难溶电解质的溶度积越小,溶解度越大 |
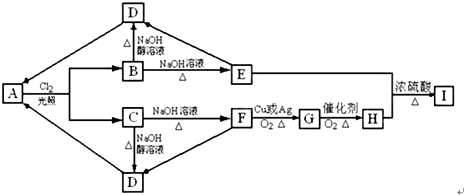

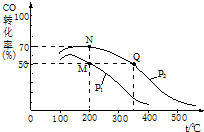 “洁净煤技术”研究在世界上相当普遍.
“洁净煤技术”研究在世界上相当普遍.