题目内容
9.将有机物完全燃烧,生成CO2和H2O.将12.4g该有机物的完全燃烧产物通过浓H2SO4,浓硫酸增重 10.8g,再通过碱石灰,碱石灰又增重了17.6g.下列说法正确的是( )| A. | 该有机物的最简式为 CH3O | B. | 该有机物的分子式可能为 CH3O | ||
| C. | 该有机物的分子式可能为 C2H6O | D. | 该有机物1H核磁共振谱中有两个峰 |
分析 浓硫酸增重的为水的质量,碱石灰增重的为二氧化碳的质量,计算出水、二氧化碳的物质的量,再根据质量守恒确定含有氧元素的质量及物质的量,根据C、H、O元素的物质的量之比得出该有机物的最简式,再根据烷烃中C、H原子数目关系确定分子式.
解答 解:将12.4g该有机物的完全燃烧产物通过浓硫酸,浓硫酸增重19.8g为水,其物质的量为:$\frac{10.8g}{18g/mol}$=0.6mol,含有H元素的物质的量为:0.6mol×2=1.2mol,H元素质量为1g/mol×1.2mol=1.2g,
通过碱石灰,碱石灰又增重的17.6g为二氧化碳的质量,其物质的量为:$\frac{17.6g}{44g/mol}$=0.4mol,原有机物中含有碳元素的质量为:12g/mol×0.4mol=4.8g,
该有机物中含有C、H元素的质量为:4.8g+1.2g=6g<12.4g,
所以该有机物分子中含有O元素,含有氧元素的物质的量为:$\frac{12.4g-6g}{16g/mol}$=0.4mol,
所以该有机物分子中C、H、O原子数之比为:0.4mol:1.2mol:0.4mol=1:3:1,其最简式为CH3O,
所以该有机物分子式为C2H6O2,可能结构简式为HOCH2CH2OH、HOCH2OCH3,前者核磁共振氢谱有个峰,后者核磁共振氢谱有3个峰,
综上所述,可知A正确,BCD错误,
故选:A.
点评 本题考查了有机物分子式确定的计算,题目难度中等,注意掌握质量守恒在确定有机物分子式、结构简式中的应用方法,试题培养了学生的分析能力及化学计算能力.

练习册系列答案
相关题目
19.下列说法中正确的是( )
| A. | 两个原子或多个原子之间的相互作用叫做化学键 | |
| B. | 阴、阳离子通过静电引力而形成的化学键叫做离子键 | |
| C. | 只有金属原子和非金属原子化合时才能形成离子键 | |
| D. | 大多数的盐、碱和金属氧化物中含有离子键 |
20.下列不能用于比较非金属元素的非金属性强弱的是( )
| A. | 单质间的置换反应 | |
| B. | 气态氢化物的稳定性 | |
| C. | 单质在水中的溶解度的大小 | |
| D. | 最高价氧化物对应水化物的酸性强弱 |
17.下列有关乙烯的说法,其中错误的是( )
| A. | 乙烯分子的双键中有一个键较易断裂 | |
| B. | 乙烯分子里所有原子都在同一平面上,且碳氢键之间的键角为120° | |
| C. | 乙烯的化学性质比乙烷活泼 | |
| D. | 乙烯和环丙烷(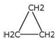 )的分子组成符合通式CnH2n,因此它们属于同系物 )的分子组成符合通式CnH2n,因此它们属于同系物 |
4.下列离子方程式不正确的是( )
| A. | 碳酸铵溶液中通入足量二氧化碳:CO32-+CO2+H2O═2HCO3- | |
| B. | 氯化铵溶液中加入稀氢氧化钠溶液:NH4++OH-?NH3•H2O | |
| C. | 氯化铵固体和熟石灰共热:NH4++OH-═NH3↑+H2O | |
| D. | 硫酸铵溶液与氢氧化钡溶液共热:2NH4++SO42-+Ba2++2OH-$\frac{\underline{\;\;△\;\;}}{\;}$ BaSO4↓+2NH3↑+2H2O |
14.A,B均为短周期元素,已知A元素原子的最外层电子数为a,次外层电子数为b; B元素原了的M 层电子数为(a-b),L层电子数为(a+b),则A、B所形成的化合物的性质可能有( )
| A. | 能与水反应 | B. | 能与NaOH溶液反应 | ||
| C. | 能与稀硫酸反应 | D. | 在空气中能燃烧 |

 .
. .
.
