题目内容
如表是元素周期表的一部分,根据表中的①~⑩中元素,用相关的化学用语填空:
(1)元素⑩的名称是 ,从元素原子得失电子的角度看,元素④具有 (填“氧化性”、“还原性”);比元素⑧质子数多16的元素在周期表中所处位置 ;
(2)⑥④⑦的氢化物稳定性由弱到强的顺序依次: (写氢化物的化学式);
(3)元素③的气态氢化物与其最高价氧化物的水化物反应的方程式为 ;
(4)写出元素⑤形成的单质在氧气中燃烧产物的电子式 ,这一反应是 (填“吸热”、“放热”)反应;元素②和④形成化合物电子式为 ;
(5)用电子式表示①与⑨反应得到的化合物的形成过程 ;
(6)某元素R的气态氢化物为HXR,且R在该氢化物中的质量分数为94%,8.5g的HXR气体在标准状态下的体积是5.6L.HXR的化学式为 .
| IA | 0 | |||||||
| 1 | ① | IIA | IIIA | IVA | VA | VIA | ⅦA | |
| 2 | ⑩ | ② | ③ | ④ | ⑧ | |||
| 3 | ⑤ | ⑥ | ⑦ | ⑨ | ||||
(2)⑥④⑦的氢化物稳定性由弱到强的顺序依次:
(3)元素③的气态氢化物与其最高价氧化物的水化物反应的方程式为
(4)写出元素⑤形成的单质在氧气中燃烧产物的电子式
(5)用电子式表示①与⑨反应得到的化合物的形成过程
(6)某元素R的气态氢化物为HXR,且R在该氢化物中的质量分数为94%,8.5g的HXR气体在标准状态下的体积是5.6L.HXR的化学式为
考点:元素周期律和元素周期表的综合应用
专题:元素周期律与元素周期表专题
分析:根据元素周期表可知:①H②C③N④O⑤Na⑥Si⑦P⑧Ne⑨S⑩B.
(1)元素⑩的名称是硼,O原子最外层6个电子,易得2个电子达到稳定结构,具有氧化性,比Ne质子数多16的元素为Fe,位于第四周期第ⅤⅢ族;
(2)根据非金属性越强,气态氢化物稳定性越强分析;
(3)N的气态氢化物是氨气,N的最高价氧化物的水化物是硝酸,氨气与硝酸反应生成硝酸铵;
(4)Na在氧气中燃烧生成过氧化钠,所有的燃烧反应均属于放热反应;C和O可形成化合物二氧化碳;
(5)H与S形成化合物是H2S,H2S是由H与S以共用电子对形成的共价化合物;
(6)先根据HXR气体的质量和体积求出其摩尔质量,然后根据相对分子质量和R在该氢化物中的质量分数求出R的原子量,得出元素R是何种元素.
(1)元素⑩的名称是硼,O原子最外层6个电子,易得2个电子达到稳定结构,具有氧化性,比Ne质子数多16的元素为Fe,位于第四周期第ⅤⅢ族;
(2)根据非金属性越强,气态氢化物稳定性越强分析;
(3)N的气态氢化物是氨气,N的最高价氧化物的水化物是硝酸,氨气与硝酸反应生成硝酸铵;
(4)Na在氧气中燃烧生成过氧化钠,所有的燃烧反应均属于放热反应;C和O可形成化合物二氧化碳;
(5)H与S形成化合物是H2S,H2S是由H与S以共用电子对形成的共价化合物;
(6)先根据HXR气体的质量和体积求出其摩尔质量,然后根据相对分子质量和R在该氢化物中的质量分数求出R的原子量,得出元素R是何种元素.
解答:
解:(1)元素⑩的名称是硼,O原子最外层6个电子,易得2个电子达到稳定结构,因此O元素具有氧化性,比Ne质子数多16的元素为Fe,位于第四周期第ⅤⅢ族;
故答案为:硼;氧化性;第四周期第ⅤⅢ族;
(2)非金属性越强,气态氢化物稳定性越强,元素非金属性:Si<P<O,气态氢化物的稳定性:SiH4<PH3<H2O,
故答案为:SiH4<PH3<H2O;
(3)N的气态氢化物是氨气,N的最高价氧化物的水化物是硝酸,氨气与硝酸反应生成硝酸铵,化学方程式为:NH3+HNO3=NH4NO3,
故答案为:NH3+HNO3=NH4NO3;
(4)Na在氧气中燃烧生成过氧化钠,过氧化钠为离子化合物,阴离子为过氧根离子,过氧化钠的电子式为 ,所有的燃烧反应均属于放热反应;C和O可形成化合物二氧化碳,碳原子分别与两个氧原子形成了两对共用电子对,二氧化碳的电子式为
,所有的燃烧反应均属于放热反应;C和O可形成化合物二氧化碳,碳原子分别与两个氧原子形成了两对共用电子对,二氧化碳的电子式为 ,
,
故答案为: ;放热;
;放热; ;
;
(5)H与S形成化合物是H2S,H2S是由H与S以共用电子对形成的共价化合物,形成过程为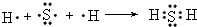 ,
,
故答案为: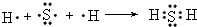 ;
;
(6)HxR气体在标准状况下的体积是5.6L,说明物质的量为5.6/22.4=0.25mol,又因为气体质量为8.5g,所以摩尔质量为
=34,因此HxR的相对分子质量为34,R在该氢化物中的质量分数为94%,所以R的原子量为34×0.94=32,所以R是S,因此HxR的化学式为H2S,
故答案为:H2S.
故答案为:硼;氧化性;第四周期第ⅤⅢ族;
(2)非金属性越强,气态氢化物稳定性越强,元素非金属性:Si<P<O,气态氢化物的稳定性:SiH4<PH3<H2O,
故答案为:SiH4<PH3<H2O;
(3)N的气态氢化物是氨气,N的最高价氧化物的水化物是硝酸,氨气与硝酸反应生成硝酸铵,化学方程式为:NH3+HNO3=NH4NO3,
故答案为:NH3+HNO3=NH4NO3;
(4)Na在氧气中燃烧生成过氧化钠,过氧化钠为离子化合物,阴离子为过氧根离子,过氧化钠的电子式为
 ,所有的燃烧反应均属于放热反应;C和O可形成化合物二氧化碳,碳原子分别与两个氧原子形成了两对共用电子对,二氧化碳的电子式为
,所有的燃烧反应均属于放热反应;C和O可形成化合物二氧化碳,碳原子分别与两个氧原子形成了两对共用电子对,二氧化碳的电子式为 ,
,故答案为:
 ;放热;
;放热; ;
;(5)H与S形成化合物是H2S,H2S是由H与S以共用电子对形成的共价化合物,形成过程为
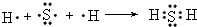 ,
,故答案为:
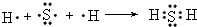 ;
;(6)HxR气体在标准状况下的体积是5.6L,说明物质的量为5.6/22.4=0.25mol,又因为气体质量为8.5g,所以摩尔质量为
| 8.5 |
| 0.25 |
故答案为:H2S.
点评:本题考查了元素周期表和元素周期律的综合应用,题目难度中等,侧重于学生对元素周期表中的一些变化规律的归纳和总结,并学以致用,同时考查了化学语言和元素及其化合物的有关知识.

练习册系列答案
相关题目
能够区分溶液和胶体的方法是( )
| A、用滤纸过滤 |
| B、观察溶液是否均匀透明 |
| C、观察能否产生丁达尔效应 |
| D、看溶液是否有沉淀生成 |
农作物收割后留下大量秸杆,下列有关秸杆的处理方法错误的是( )
| A、做饲料 | B、造纸 |
| C、制沼气 | D、就地焚烧 |
