题目内容
20.为除去括号内的杂质,所选用的试剂或方法不正确的是( )| A. | NaCO3溶液(NaHCO3),选用适量NaOH溶液 | |
| B. | NaHCO3溶液(NaCO3),应通入过量CO2气体 | |
| C. | Na2O2粉末(Na2O),将混合物在空气中加热 | |
| D. | 镁粉(铝粉),选用过量的烧碱溶液 |
分析 A.NaHCO3与NaOH反应可生成Na2CO3;
B.CO2与Na2CO3溶液反应生成NaHCO3;
C.应防止过氧化钠与二氧化碳反应;
D.铝与氢氧化钠溶液反应.
解答 解:A.NaHCO3与NaOH反应可生成Na2CO3,加入适量,可用于除去Na2CO3中混有的NaHCO3,故A正确;
B.CO2与Na2CO3溶液反应生成NaHCO3,可用于除杂,故B正确;
C.加热条件下氧化钠可与氧气反应生成过氧化钠,但过氧化钠易与二氧化碳反应生成碳酸钠而变质,故C错误;
D.Mg不与烧碱溶液反应,但Al可与烧碱溶液反应生成溶于水的偏铝酸钠,所以可用烧碱溶液除去镁中的少量铝,故D正确.
故选C.
点评 本题考查物质的分离、提纯知识,为高考常见题型和高频考点,侧重于学生的分析能力和实验能力的考查,除杂时注意不能引入新的杂质且不能影响被提纯物质的性质,注意把握物质的性质的异同,难度不大.

练习册系列答案
相关题目
10. 替米沙坦片是治疗原发性高血压的一种白色药片,其主要成份为替米沙坦,化学结构如图所示.下列关于替米沙坦的说法中错误的是( )
替米沙坦片是治疗原发性高血压的一种白色药片,其主要成份为替米沙坦,化学结构如图所示.下列关于替米沙坦的说法中错误的是( )
 替米沙坦片是治疗原发性高血压的一种白色药片,其主要成份为替米沙坦,化学结构如图所示.下列关于替米沙坦的说法中错误的是( )
替米沙坦片是治疗原发性高血压的一种白色药片,其主要成份为替米沙坦,化学结构如图所示.下列关于替米沙坦的说法中错误的是( )| A. | 该物质属于芳香族化合物 | |
| B. | 能发生加成反应、取代反应和酯化反应 | |
| C. | 替米沙坦的分子式为C32H28O2N4 | |
| D. | 能使酸性高锰酸钾溶液褪色 |
8.除去BaCl2 溶液的少量盐酸,最好选择的试剂是( )
| A. | Ba(OH)2溶液 | B. | BaCO3粉末 | C. | AgNO3溶液 | D. | NaOH溶液 |
15. 煤化工是以煤为原料,经过化学加工使煤转化为气体、液体、固体燃料以及各种化工产品的工业过程.
煤化工是以煤为原料,经过化学加工使煤转化为气体、液体、固体燃料以及各种化工产品的工业过程.
(1)将水蒸气通过红热的碳即可产生水煤气.反应为:C(s)+H2O(g)?CO(g)+H2(g)△H=+131.3kJ•mol-1一定温度下,在一个容积固定的密闭容器中,发生上述反应,下列不能判断该反应达到化学平衡状态的是d (填字母).
a.容器中的压强不变 b.1mol H-H键断裂的同时断裂2mol H-O键
c. v正(CO)=v逆(H2O) d.c(CO)=c(H2)
(2)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应
CO(g)+H2O(g)?CO2(g)+H2(g),得到如下三组数据:
①该反应的逆反应为吸 (填“吸”或“放”)热反应
②若实验3要达到与实验2中各物质的质量分数分别相等,且t<3min,则a、b应满足的关系是b=2a且a>l (用含a、b的数学式表示).
(3)目前工业上有一种方法是用CO2来生产甲醇.一定条件下发生反应:
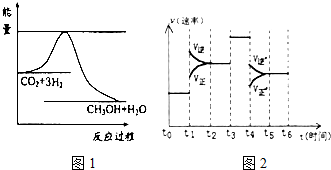
CO2(g)+3H2(g)?CH3OH(g)+H2O(g)图1表示该反应进行过程中能量(单位为kJ?mol.)的变化.
①在体积为1L的恒容密闭容器中,充入l molCO2和3molH2,下列措施中能使 c (CH3OH)增大的是cd (填字母)
a.升高温度
b.充入He (g),使体系压强增大
c.将H2O(g)从体系中分离出来
d.再充入l mol CO2和3molH2
②当反应达到平衡时不断改变条件(但不改变各组分物质的量和状态)反应速率随时间的变化如图2:其中表示平衡混合物中CH3OH含量最高的一段时间是t0~t1;如t0~t1平衡常数为K1,t2~t3平衡常数为K2,则K1大于K2(填“大于”、“等于”或“小于”).
 煤化工是以煤为原料,经过化学加工使煤转化为气体、液体、固体燃料以及各种化工产品的工业过程.
煤化工是以煤为原料,经过化学加工使煤转化为气体、液体、固体燃料以及各种化工产品的工业过程.(1)将水蒸气通过红热的碳即可产生水煤气.反应为:C(s)+H2O(g)?CO(g)+H2(g)△H=+131.3kJ•mol-1一定温度下,在一个容积固定的密闭容器中,发生上述反应,下列不能判断该反应达到化学平衡状态的是d (填字母).
a.容器中的压强不变 b.1mol H-H键断裂的同时断裂2mol H-O键
c. v正(CO)=v逆(H2O) d.c(CO)=c(H2)
(2)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应
CO(g)+H2O(g)?CO2(g)+H2(g),得到如下三组数据:
| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| CO | H2O | H2 | CO2 | |||
| 1 | 650 | 2 | 4 | 1.6 | 1.6 | 5 |
| 2 | 900 | 1 | 2 | 0.4 | 0.4 | 3 |
| 3 | 900 | a | b | c | d | t |
②若实验3要达到与实验2中各物质的质量分数分别相等,且t<3min,则a、b应满足的关系是b=2a且a>l (用含a、b的数学式表示).
(3)目前工业上有一种方法是用CO2来生产甲醇.一定条件下发生反应:
CO2(g)+3H2(g)?CH3OH(g)+H2O(g)图1表示该反应进行过程中能量(单位为kJ?mol.)的变化.
①在体积为1L的恒容密闭容器中,充入l molCO2和3molH2,下列措施中能使 c (CH3OH)增大的是cd (填字母)
a.升高温度
b.充入He (g),使体系压强增大
c.将H2O(g)从体系中分离出来
d.再充入l mol CO2和3molH2
②当反应达到平衡时不断改变条件(但不改变各组分物质的量和状态)反应速率随时间的变化如图2:其中表示平衡混合物中CH3OH含量最高的一段时间是t0~t1;如t0~t1平衡常数为K1,t2~t3平衡常数为K2,则K1大于K2(填“大于”、“等于”或“小于”).
5.常温下,下列各组离子一定能在指定溶液中大量共存的是( )
| A. | 使酚酞变红色的溶液中:Na+、Al3+、SO42-、Cl- | |
| B. | Kw/c(OH-)=1×10-13mol•L-1的溶液中:NH4+、Ca2+、Cl-、NO3- | |
| C. | 与Al反应能放出H2的溶液中:Fe2+、K+、NO3-、SO42- | |
| D. | c(H+)=1×10-13mol•L-1的溶液中:K+、Na+、AlO2-、CO32- |
12.不饱和酯类化合物在药物、涂料等应用广泛.下列化合物I的说法,正确的是( )

| A. | 遇FeCl3溶液可能显紫色 | |
| B. | 可发生酯化反应和银镜反应 | |
| C. | 能与溴发生取代和加成反应 | |
| D. | 1mol化合物I最多能与2molNaOH反应 |
9.设NA为阿伏加德罗常数的值,下列说法正确的是( )
| A. | 高温下,16.8g Fe与足量水蒸气完全反应失去电子数为0.8NA | |
| B. | 一定条件下Fe粉与足量的浓硫酸反应,转移电子数为3NA | |
| C. | 在1L的碳酸钠溶液中,若c(CO32- )=1mol•L-1,则溶液中Na+的个数为2NA | |
| D. | 含4NA个离子的固体Na2O2溶于水配成1L溶液,所得溶液中c(Na+)=2mol•L-1 |
10.下列依据热化学方程式得出的结论正确的是( )
| A. | 已知2H2(g)+O2(g)═2H2O(l)△H=-483.6 kJ•mol-1,则2molH2(g)和1molO2(g)所含有的总能量比2molH2O(l)所含有的总能量少483.6kJ | |
| B. | 已知2C(s)+2O2(g)═2CO2(g)△H1;2C(s)+O2(g)=2CO(g)△H2,则△H1>△H2 | |
| C. | 已知C(石墨,s)=C(金刚石,s)△H>0,则金刚石比石墨稳定 | |
| D. | 热化学方程式中的化学计量数只表示物质的量,可以是分数 |