题目内容
下列叙述正确的是( )
| A、向Al2(SO4)3溶液中滴加过量的NaOH溶液制备Al(OH)3 |
| B、向水玻璃中滴加盐酸制备硅酸 |
| C、用加热法除去Ca(OH)2固体中混有的NH4Cl固体 |
| D、SO2通入酸性KMnO4溶液检验其漂白性 |
考点:物质的分离、提纯和除杂,二氧化硫的化学性质,硅酸的性质及制法,两性氧化物和两性氢氧化物
专题:
分析:A、氢氧化铝为两性氢氧化物,能与强碱反应生成偏铝酸盐;
B、硅酸的酸性弱于碳酸,硅酸钠与盐酸反应生成硅酸;
C、氢氧化钙与氯化铵加热反应生成氨气;
D、二氧化硫具有还原性,高锰酸钾溶液具有氧化性.
B、硅酸的酸性弱于碳酸,硅酸钠与盐酸反应生成硅酸;
C、氢氧化钙与氯化铵加热反应生成氨气;
D、二氧化硫具有还原性,高锰酸钾溶液具有氧化性.
解答:
解:A、氢氧化铝为两性氢氧化物,能与强碱反应生成偏铝酸盐,即过量的NaOH溶液与硫酸铝反应得不到Al(OH)3,故A错误;
B、硅酸的酸性弱于碳酸,硅酸钠与盐酸反应生成硅酸,故B正确;
C、氢氧化钙与氯化铵加热反应生成氨气,故不能利用此方法除去氢氧化钙中的氯化铵,故C错误;
D、二氧化硫具有还原性,高锰酸钾溶液具有氧化性,二氧化硫使其褪色,是氧化还原反应不是漂白性,故D错误,故选B.
B、硅酸的酸性弱于碳酸,硅酸钠与盐酸反应生成硅酸,故B正确;
C、氢氧化钙与氯化铵加热反应生成氨气,故不能利用此方法除去氢氧化钙中的氯化铵,故C错误;
D、二氧化硫具有还原性,高锰酸钾溶液具有氧化性,二氧化硫使其褪色,是氧化还原反应不是漂白性,故D错误,故选B.
点评:本题主要考查的是二氧化硫的性质、氢氧化铝的两性、强酸制取弱酸原理,综合性较强,难度不大.

练习册系列答案
相关题目
下列分子中,共价键的极性最强的是( )
| A、NH3 |
| B、H2S |
| C、CH4 |
| D、H2O |
常温条件下,下列各组比值为1:2的是( )
| A、0.1 mol/L Na2CO3溶液,c(CO32-)与c(Na+)之比 |
| B、0.1 mol/L与0.2 mol/L 醋酸溶液,c(H+) 之比 |
| C、pH=3的硫酸与醋酸溶液,c(SO42-)与c(CH3COO-)之比 |
| D、pH=10的Ba(OH)2溶液与氨水,溶质的物质的量浓度之比 |
不同温度(T1和T2)时,硫酸钡在水中的沉淀溶解平衡曲线如图所示,已知硫酸钡在水中溶解时吸收热量.下列说法正确的是( )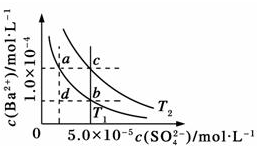

| A、T1>T2 |
| B、加入BaCl2固体,可使a点变成c点 |
| C、c点时,在T1、T2两个温度下均有固体析出 |
| D、a点和b点的Ksp相等 |
下列物质中既能跟氢气反应,又能跟KMnO4酸性溶液反应;既不能跟溴水反应,又不能发生加聚反应的是( )
| A、裂化汽油 | B、甲苯 |
| C、聚乙烯 | D、苯 |
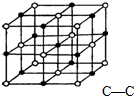 科学家最近发现一种由钛原子和碳原子构成的气态团簇分子,如图1所示:图中顶角和面心的原子都是钛原子,棱的中心和体心的原子都是碳原子该分子的化学式是( )
科学家最近发现一种由钛原子和碳原子构成的气态团簇分子,如图1所示:图中顶角和面心的原子都是钛原子,棱的中心和体心的原子都是碳原子该分子的化学式是( )| A、Ti13C114 |
| B、Ti14C113 |
| C、Ti4C5 |
| D、TiC |

 的化学方程式
的化学方程式