题目内容
下列物质中酸性最强的是( )
| A、HClO4 |
| B、H2SO4 |
| C、H3PO4 |
| D、H2SiO4 |
考点:非金属在元素周期表中的位置及其性质递变的规律
专题:
分析:首先根据元素周期律比较元素的非金属性强弱,根据元素的非金属性越强,对应的最高价氧化物的水化物的酸性越强判断.
解答:
解:同周期元素从左到右元素的非金属性逐渐增强,则非金属性:Cl>S>P>Si,元素的非金属性越强,对应的最高价氧化物的水化物的酸性越强,Cl的非金属性最强,则HClO4酸性最强.
故选A.
故选A.
点评:本题考查元素的非金属性的比较以及对应最高价氧化物的水化物的酸性的比较,题目难度不大,注意元素的非金属性与最高价含氧酸的关系.

练习册系列答案
相关题目
目前人类已发现的非金属除稀有气体外共有16种,下列对这16种非金属元素的相关判断正确的是( )
①都是主族元素,最外层电子数都大于4
②常温下气体单质都是双原子分子
③最高正化合价与最低负化合价代数和为0的元素有3种
④氢化物在常温下都是气态
⑤能形成既含离子键又含共价键的化合物.
①都是主族元素,最外层电子数都大于4
②常温下气体单质都是双原子分子
③最高正化合价与最低负化合价代数和为0的元素有3种
④氢化物在常温下都是气态
⑤能形成既含离子键又含共价键的化合物.
| A、①②④ | B、②③⑤ |
| C、③⑤ | D、①④ |
下列各组物质的分类正确的是( )
①混合物:水玻璃、水银、水煤气 ②电解质:明矾、石膏、水
③酸性氧化物:CO2、CO、SO3 ④同位素:1H、2H2、3H
⑤同素异形体:C60、金刚石、石墨 ⑥干冰、液氯都是非电解质.
①混合物:水玻璃、水银、水煤气 ②电解质:明矾、石膏、水
③酸性氧化物:CO2、CO、SO3 ④同位素:1H、2H2、3H
⑤同素异形体:C60、金刚石、石墨 ⑥干冰、液氯都是非电解质.
| A、①②③④⑤⑥ | B、②④⑤⑥ |
| C、②⑤⑥ | D、②⑤ |
常温条件下,下列各组比值为1:2的是( )
| A、0.1 mol/L Na2CO3溶液,c(CO32-)与c(Na+)之比 |
| B、0.1 mol/L与0.2 mol/L 醋酸溶液,c(H+) 之比 |
| C、pH=3的硫酸与醋酸溶液,c(SO42-)与c(CH3COO-)之比 |
| D、pH=10的Ba(OH)2溶液与氨水,溶质的物质的量浓度之比 |
不同温度(T1和T2)时,硫酸钡在水中的沉淀溶解平衡曲线如图所示,已知硫酸钡在水中溶解时吸收热量.下列说法正确的是( )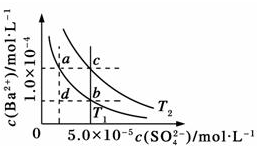

| A、T1>T2 |
| B、加入BaCl2固体,可使a点变成c点 |
| C、c点时,在T1、T2两个温度下均有固体析出 |
| D、a点和b点的Ksp相等 |
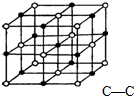 科学家最近发现一种由钛原子和碳原子构成的气态团簇分子,如图1所示:图中顶角和面心的原子都是钛原子,棱的中心和体心的原子都是碳原子该分子的化学式是( )
科学家最近发现一种由钛原子和碳原子构成的气态团簇分子,如图1所示:图中顶角和面心的原子都是钛原子,棱的中心和体心的原子都是碳原子该分子的化学式是( )| A、Ti13C114 |
| B、Ti14C113 |
| C、Ti4C5 |
| D、TiC |