题目内容
18.短周期元素A~I的原子半径和化合价数据见表:| 元素编号 | A | B | C | D | E | F | G | H | I |
| 原子半径/nm | 0.037 | 0.071 | 0.074 | 0.075 | 0.082 | 0.102 | 0.143 | 0.152 | 0.186 |
| 最高或最 低化合价 | +1 | -1 | -2 | -3 | +3 | -2 | +3 | +1 | +1 |
(1)E、G、H对应的元素符号分别是B、Al、Li.
(2)上述所有元素中,非金属性最强的是F(填元素符号,下同).
(3)C元素与其他元素均能形成二元化合物,与其形成二元化合物种类最多的元素是N.
(4)F、G、H三种元素的简单离子中,半径最大的是S2-(填离子符号).
(5)由A、E和I三种元素组成的化合物IEA4,被称为“万能还原剂”,其受热分解生成离子化合物IA和两种非金属单质,则该反应的化学方程式为2NaBH4$\frac{\underline{\;\;△\;\;}}{\;}$2NaH+3H2↑+2B.IA中A-离子的结构示意图为
 .
.
分析 短周期元素A~I的原子半径和化合价数据见表,A、H、I元素的最高价都是+1价,原子半径I>H>A,则A、H、I分别为H、Li、Na元素;C、F的最低价都是-2,原子半径C<F,则C、F分别为O、S元素;B的最低价为-1价,原子半径B<C,则B为F元素;D的最低价为-3价,位于ⅤA族,原子半径D<S,则D为N元素;E、G的最高价为+3价,原子半径E<G,则E、G分别为B、Al元素,据此结合元素周期律知识解答.
解答 解:短周期元素A~I的原子半径和化合价数据见表,A、H、I元素的最高价都是+1价,原子半径I>H>A,则A、H、I分别为H、Li、Na元素;C、F的最低价都是-2,原子半径C<F,则C、F分别为O、S元素;B的最低价为-1价,原子半径B<C,则B为F元素;D的最低价为-3价,位于ⅤA族,原子半径D<S,则D为N元素;E、G的最高价为+3价,原子半径E<G,则E、G分别为B、Al元素,
(1)根据分析可知,E、G、H对应的元素符号分别是B、Al、Li,
故答案为:B;Al;Li;
(2)同一主族,原子序数越大非金属性越弱,同一周期原子序数越大,非金属性越强,则上述所有元素中非金属性最强的是F,
故答案为:F;
(3)C为O元素,O元素与其他元素均能形成二元化合物,其中N的氧化物种类最多,即O与N元素形成的二元化合物种类最多,
故答案为:N;
(4)F、G、H分别为S、Al、Li元素,三种元素的简单离子中,离子的电子层越多,离子半径越大,电子层相同时离子的核电荷数越大,离子半径越小,则半径最大的是S2-,
故答案为:S2-;
(5)由A、E和I三种元素组成的化合物IEA4为NaBH4,被称为“万能还原剂”,NaBH4受热分解生成离子化合物IA(NaH)和两种非金属单质,两种按照只能为H2和B,该反应的化学方程式为:2NaBH4$\frac{\underline{\;\;△\;\;}}{\;}$2NaH+3H2↑+2B;
IA中A-离子为H-,其核电荷数为1,核外电子总数为2,其离子结构示意图为: ,
,
故答案为:2NaBH4$\frac{\underline{\;\;△\;\;}}{\;}$2NaH+3H2↑+2B; .
.
点评 本题考查位置结构与性质关系的应用,题目难度中等,根据表中数据正确推断元素为解答关键,注意熟练掌握原子结构与元素周期律之间的关系,试题有利于提高学生的分析能力及综合应用能力.

 阅读快车系列答案
阅读快车系列答案| A. | 在配制一定物质的量浓度溶液的定容步骤时,俯视凹液面,所配溶液浓度偏高 | |
| B. | 向盛有5mL 4%和5mL 12%的过氧化氢溶液中分别加入几滴等浓度的氯化铁溶液,后者产生气泡速率快 | |
| C. | KI溶液中加少量新制的氯水,再加少量苯充分振荡后静置,上层为紫红色 | |
| D. | 用pH试纸测溶液的pH和用红色石蕊试纸检测气体时均不需要润湿 |
| A. | NaCl | B. | MgCl2 | C. | NaHCO3 | D. | H2CO3 |

 尿素[CO(NH2)2]是首个由无机物人工合成的有机物.
尿素[CO(NH2)2]是首个由无机物人工合成的有机物.
 +2nH2O⑩
+2nH2O⑩
 +CH2═CH-M$→_{碱}^{Pb}$
+CH2═CH-M$→_{碱}^{Pb}$ =CH-M+HX(X为卤原子,M为烃基或含酯基的取代基等),由有机物A合成G(香豆素)的步骤如下:
=CH-M+HX(X为卤原子,M为烃基或含酯基的取代基等),由有机物A合成G(香豆素)的步骤如下: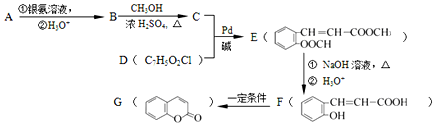
 .
. 中任意2种.
中任意2种. 的路线流程图:
的路线流程图: .
. 如图是金属镁和卤素反应的能量变化图(反应物和产物均为298K时的稳定状态).由图可知Mg与卤素单质的反应均为放热(填“放热”或“吸热”)反应.
如图是金属镁和卤素反应的能量变化图(反应物和产物均为298K时的稳定状态).由图可知Mg与卤素单质的反应均为放热(填“放热”或“吸热”)反应.