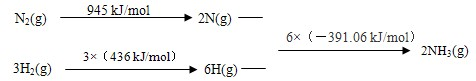题目内容
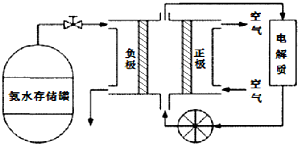
 利用如图所示装置可以模拟钢铁的电化学防护.下列说法正确的是( )
利用如图所示装置可以模拟钢铁的电化学防护.下列说法正确的是( )| A、若X为锌棒,开关K置于M处,铁极发生还原反应 |
| B、若X为碳棒,开关K置于N处,X极发生还原反应 |
| C、若X为碳棒,开关K置于N处,可加快铁的腐蚀 |
| D、若X为锌棒,开关K置于M处,可加快铁的腐蚀 |
考点:原电池和电解池的工作原理
专题:电化学专题
分析:开关置于N处,该装置是电解池,X作阳极,铁作阴极,阳极上失电子发生氧化反应,阴极上得电子发生还原反应,为外加电源的阴极保护法;
开关置于M处,该装置是原电池,较活泼的金属作负极,负极上失电子发生氧化反应,正极上得电子发生还原反应,为牺牲阳极的阴极保护法.
开关置于M处,该装置是原电池,较活泼的金属作负极,负极上失电子发生氧化反应,正极上得电子发生还原反应,为牺牲阳极的阴极保护法.
解答:
解:A.若X为锌棒,开关K置于M处,形成原电池反应,锌为负极,发生氧化反应,铁为正极,发生还原反应,故A正确;
B.若X为碳棒,开关K置于N处,X极为阳极,发生氧化反应,故B错误;
C.若X为碳棒,开关K置于N处,铁为阴极,难以被腐蚀,故C错误;
D.若X为锌棒,开关K置于M处,锌为负极,铁为正极,锌被腐蚀,铁被保护,故D错误.
故选A.
B.若X为碳棒,开关K置于N处,X极为阳极,发生氧化反应,故B错误;
C.若X为碳棒,开关K置于N处,铁为阴极,难以被腐蚀,故C错误;
D.若X为锌棒,开关K置于M处,锌为负极,铁为正极,锌被腐蚀,铁被保护,故D错误.
故选A.
点评:本题考查了原电池和电解池原理,为高频考点,注意当活泼电极作电解池阳极时,阳极上金属材料失电子而不是电解质溶液中阴离子失电子,为易错点.

练习册系列答案
相关题目
 质子交换膜燃料电池(proton exchange membrane fuel cell,英文简称PEMFC)是燃料电池的一种.如图是质子交换膜氢氧燃料电池,下列有关该电池的原理的描述正确的是( )
质子交换膜燃料电池(proton exchange membrane fuel cell,英文简称PEMFC)是燃料电池的一种.如图是质子交换膜氢氧燃料电池,下列有关该电池的原理的描述正确的是( )| A、溶液中H+透过质子交换膜从右向左迁移 |
| B、b极发生氧化反应 |
| C、电子从a极流出经溶液流到b极 |
| D、该电池在使用过程中,H+的物质的量保持不变 |
一定温度下,可逆反应H2(g)+I2(g)?2HI(g)达到限度的标志是( )
| A、H2,I2,HI三种物质的浓度一定相等 |
| B、H2,I2全部反应生成了HI |
| C、H2,I2,HI三种物质的浓度保持不变 |
| D、反应中正反应速率逐渐减小,最后减小为零 |
下列关于煤、石油、天然气等资源的说法正确的是( )
| A、石油裂解得到的汽油可用于作溴水中进取溴的萃取剂 |
| B、可利用干馏的方法将煤中的苯和苯酚等分离 |
| C、石油分馏产品可在催化剂作用下,通过裂化反应,从而提高汽油的产量和质量 |
| D、水煤气是通过煤的液化得到的气体燃料 |
下列判断错误的是( )
| A、稳定性:H2O>H2S>H2Se |
| B、半径:Na+>Mg2+>F- |
| C、酸性:HClO4>H2SO4>H3PO4 |
| D、碱性:NaOH>Mg(OH)2>Al(OH)3 |
下列说法或表示正确的是( )
| A、等物质的量的硫蒸气和硫固体分别完全燃烧,后者放出的热量少 |
| B、A、B互为同素异形体,由A转化为B时△H═+119 kJ?mol-1可知B比A稳定 |
| C、对△H<0的化学反应,不需要加热,一定能够自发进行到底 |
| D、在101kPa时,H2燃烧的热化学方程式为2H2(g)+O2(g)═2H2O(l)△H═-571.6kJ?mol-1,则H2在101kPa时的燃烧热为571.6kJ?mol-1 |