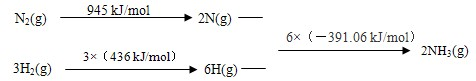题目内容
下列说法正确的是( )
| A、等浓度的:①醋酸,②苯酚,③苯酚钠,④碳酸,⑤碳酸钠,⑥碳酸氢钠.按溶液pH由小到大排列顺序是①④②⑥③⑤ |
| B、标况下,将0.1mol?L-1的氨水溶液中加入氯化铵晶体,若混合溶液pH=7,则c(NH4+)=c(Cl-) |
| C、饱和纯碱(Na2CO3)溶液中:2c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3) |
| D、0.01 mol?L-1的Na2HPO4溶液中存在如下的平衡:HPO42-+H2O?H2PO4-+OH-;HPO42-?H++PO43-且溶液pH>7;加水稀释后溶液中HPO43-、PO43-、H+的浓度均减小 |
考点:盐类水解的应用,离子浓度大小的比较
专题:盐类的水解专题
分析:A、按照溶液的酸碱性进行分组,再考虑电解质的强弱以及盐类水解的程度,可比较溶液的pH大小;
B、常温下pH=7溶液显中性;
C、根据溶液中物料守恒分析;
D、碱性溶液加水稀释,溶液的碱性减弱.
B、常温下pH=7溶液显中性;
C、根据溶液中物料守恒分析;
D、碱性溶液加水稀释,溶液的碱性减弱.
解答:
解:A、①②④属于酸,由于醋酸酸性比碳酸强,碳酸的酸性比苯酚强,则pH①<④<②;③⑤⑥均属于强碱弱酸盐,根据越弱越水解的原理知,因H2CO3>苯酚>HCO3-,所以对应的盐的碱性为:碳酸钠>苯酚钠>碳酸氢钠,则按溶液pH由小到大排列正确的是①④②⑥③⑤,故A正确;
B、常温下pH=7溶液显中性,c(H+)=c(OH-),根据电荷守恒:c(NH4+)+c(H+)=c(Cl-)+c(OH-),则c(NH4+)=c(Cl-);标况下,温度为℃,PH=7不是中性溶液,故B错误;
C、饱和纯碱(Na2CO3)溶液中存在物料守恒,n(Na)=2n(C),则c(Na+)=2[c(CO32-)+c(HCO3-)+c(H2CO3)],故C错误;
D、碱性溶液加水稀释,溶液的碱性减弱,0.01 mol?L-1的Na2HPO4溶液中存在如下的平衡:HPO42-+H2O?H2PO4-+OH-;HPO42-?H++PO43-且溶液pH>7;加水稀释后溶液的PH减小,氢氧根离子的浓度减小,则氢离子的浓度增大,故D错误.
故选A.
B、常温下pH=7溶液显中性,c(H+)=c(OH-),根据电荷守恒:c(NH4+)+c(H+)=c(Cl-)+c(OH-),则c(NH4+)=c(Cl-);标况下,温度为℃,PH=7不是中性溶液,故B错误;
C、饱和纯碱(Na2CO3)溶液中存在物料守恒,n(Na)=2n(C),则c(Na+)=2[c(CO32-)+c(HCO3-)+c(H2CO3)],故C错误;
D、碱性溶液加水稀释,溶液的碱性减弱,0.01 mol?L-1的Na2HPO4溶液中存在如下的平衡:HPO42-+H2O?H2PO4-+OH-;HPO42-?H++PO43-且溶液pH>7;加水稀释后溶液的PH减小,氢氧根离子的浓度减小,则氢离子的浓度增大,故D错误.
故选A.
点评:本题考查了盐的水解原理的应用、溶液中电荷守恒和物料守恒的应用等,明确溶液中的守恒关系是解决本题的关键,题目难度中等.

练习册系列答案
相关题目
下列判断错误的是( )
| A、稳定性:H2O>H2S>H2Se |
| B、半径:Na+>Mg2+>F- |
| C、酸性:HClO4>H2SO4>H3PO4 |
| D、碱性:NaOH>Mg(OH)2>Al(OH)3 |
下列说法或表示正确的是( )
| A、等物质的量的硫蒸气和硫固体分别完全燃烧,后者放出的热量少 |
| B、A、B互为同素异形体,由A转化为B时△H═+119 kJ?mol-1可知B比A稳定 |
| C、对△H<0的化学反应,不需要加热,一定能够自发进行到底 |
| D、在101kPa时,H2燃烧的热化学方程式为2H2(g)+O2(g)═2H2O(l)△H═-571.6kJ?mol-1,则H2在101kPa时的燃烧热为571.6kJ?mol-1 |
在密闭容器中的一定量混合气体发生反应:xA(g)+yB(g)?zC(g),平衡时测得A的浓度0.50mol/L,保持温度不变,将容器的容积大到原来的两倍,再达平衡时,测得A的浓度降低为0.30mol/L.下列有关判断错误的是( )
| A、x+y<z |
| B、平衡向逆反应方向移动 |
| C、B的转化率降低 |
| D、C的体积分数下降 |
下列有关化学用语使用正确的是( )
A、硫原子的原子结构示意图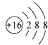 | ||
B、NH4Cl的电子式: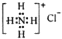 | ||
C、原子核内有10个中子的氧原子:
| ||
| D、基态铜原子的电子排布式为:1s22s22p63s23p63d94s2 |
取质量均为6.5g的两份锌粉a和b,分别加入100mL 2mol/L的稀硫酸中,并向a中加入少量CuSO4溶液,下列说法正确的是( )
| A、a比b 生成氢气的速率快,生成氢气的总量相同 |
| B、b比a 生成氢气的速率快,生成氢气的总量相同 |
| C、a比b 生成氢气的速率快,生成氢气的总量a比b多 |
| D、a比b 生成氢气的速率快,生成氢气的总量a比b少 |
下列各组中的离子或分子在指定溶液中一定能大量共存的是( )
| A、c(KNO3)=1.0mol/L的溶液中:Fe2+、Cl-、H+、Na+ | ||
| B、常温下,由水电离出的c(H+)=10-14mol/L溶液中:NH4+、CO32-、CH3COO-、SO42- | ||
| C、加入铝能产生大量氢气的溶液中:CH3CHO、MnO4-、K+、C6H5O- | ||
D、常温下,
|