题目内容
2.下列说法不正确的是( )| A. | 在化学反应中,伴随着物质的变化,既有化学键的断裂又有化学键的形成,还有化学能的改变 | |
| B. | 在化学反应过程中是放出热量还是吸收热量,取决于反应物总能量与生成物总能量的相对大小 | |
| C. | 需要加热的化学反应,该化学反应过程一定是吸收能量 | |
| D. | 物质具有的能量越低,其稳定性越大,反应越难以发生;物质具有的能量越高,其稳定性越小,反应越容易发生 |
分析 A.化学反应中一定有化学键的断裂和生成,一定有新物质生成;
B.反应物总能量小于生成物总能量为吸热反应,反之为放热反应;
C.反应中能量变化与反应条件无关;
D.能量越低的物质,越稳定.
解答 解:A.化学反应中一定有化学键的断裂和生成,一定有新物质生成,则反应在有物质变化、能量变化,故A正确;
B.反应物总能量小于生成物总能量为吸热反应,反之为放热反应,则放出热量还是吸收热量,取决于反应物总能量与生成物总能量的相对大小,故B正确;
C.反应中能量变化与反应条件无关,加热的可能为放热反应,如C的燃烧,加热可能为吸热反应,如C与二氧化碳加热生成CO,故C错误;
D.能量越低的物质,越稳定,则反应越难以发生,反之物质具有的能量越高,其稳定性越小,反应越容易发生,故D正确;
故选C.
点评 本题考查反应热与焓变,为高频考点,把握反应中能量变化、吸热反应与放热反应的判断为解答的关键,侧重分析与应用能力的考查,注意选项C为易错点,题目难度不大.

练习册系列答案
相关题目
12.下列各组分子、离子在指定溶液中一定能大量共存的是( )
| A. | 含Fe3+的溶液中: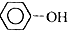 、Na+、NO3-、SO42- 、Na+、NO3-、SO42- | |
| B. | pH=13的溶液中:Na+、K+、S2-、SO32- | |
| C. | 能使淀粉KI试纸显蓝色的溶液中:NH4+、Fe2+、NO3-、Cl- | |
| D. | 在水电离的c(OH-)=10-13mol/L的溶液中:Na+、Ba2+、ClO-、NH4+ |
13.下列说法不正确的是( )
| A. | 胶体与其他分散系的本质区别是粒子直径的大小在1-100nm之间 | |
| B. | 可以利于丁达尔效应区分胶体和溶液 | |
| C. | 胶体均能发生布朗运动和电泳现象 | |
| D. | 胶体在一定条件下能稳定存在 |
10.某烃分子中含一个苯环结构和两个三键,则该烃的化学式不可能是( )
| A. | C10H6 | B. | C13H12 | C. | C15H16 | D. | C19H22 |
17.下列措施或事实不能用勒沙特列原理解释的是( )
| A. | 实验室用排饱和食盐水的方法收集氯气 | |
| B. | 棕红色的NO2加压后颜色先变深后变浅(已知:2NO2 (g)?N2O4 (g)) | |
| C. | 工业上生产硫酸的过程中,使用过量的空气以提高SO2的利用率 | |
| D. | 用硫酸氢钠去除暖水瓶中的水垢 |
14.已知W、X、Y、Z为短周期元素,原子序数依次增大.W、Z同主族,X、Y、Z同周期,其中只有X为金属元素.下列说法正确的是( )
| A. | 原子半径:W>X>Y>Z | |
| B. | 酸性:W的含氧酸强于Z的含氧酸 | |
| C. | 稳定性:Z的气态氢化物强于Y气态氢化物 | |
| D. | X与Z形成化合物一定是离子化合物 |
11.以下数值大于或等于阿伏伽德罗常数的是( )
| A. | 常温常压下,5.6L甲烷中的共价键数目 | |
| B. | 标准状况下,17gND3中所含分子数目 | |
| C. | 向0.2 mol NH4Al(SO4)2溶液中滴加NaOH溶液至沉淀完全溶解,消耗的OH-数目 | |
| D. | 0.1mol羟基(-OH)中所含电子数目 |

