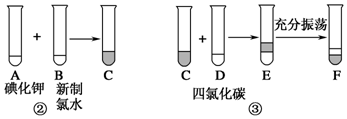
题目内容
3.工业上用化学法除锅炉的水垢时,先向锅炉中注入饱和Na2CO3溶液浸泡,将水垢中的CaSO4转化为CaCO3,再用盐酸除去[已知:Ksp(CaCO3)=1×1010,Ksp(CaSO4)=9×10-6].下列说法错误的是( )| A. | 温度升高,Na2CO3溶液的Ksp和c(OH-)均会增大 | |
| B. | 沉淀转化的离子方程式为CO32-(aq)+CaSO4(s)?CaCO3(s)+SO42-(aq) | |
| C. | 该条件下,CaCO3的溶解度约为1×10-3g | |
| D. | CaCO3和CaSO4共存的悬浊液中,$\frac{c(S{{O}_{4}}^{2-})}{c(C{{O}_{3}}^{2-})}$=9×104 |
分析 A.升高温度,促进水解,碱性增强;
B.由Ksp可知,CaCO3更难溶;
C.结合c(CO32-)=c(Ca2+)=$\sqrt{Ksp(CaC{O}_{3})}$计算;
D.CaCO3和CaSO4共存的体系中,$\frac{c(S{{O}_{4}}^{2-})}{c(C{{O}_{3}}^{2-})}$=$\frac{\sqrt{Ksp(CaS{O}_{4})}}{\sqrt{Ksp(CaC{O}_{3})}}$.
解答 解:A.升高温度,促进水解,碱性增强,Na2CO3溶液中钠离子浓度不变,氢离子浓度减小,其它离子浓度增大,故A错误;
B.由Ksp可知,CaCO3更难溶,沉淀转化的离子方程式为CO32-(aq)+CaSO4(s)?CaCO3(s)+SO42-(aq),故B正确;
C.由c(CO32-)=c(Ca2+)=$\sqrt{Ksp(CaC{O}_{3})}$=10-5mol/L,设溶液为1L,则$\frac{S}{100}$=$\frac{1{0}^{-5}mol×100g/mol}{1000g}$,解得S=10-4g,该条件下CaCO3的溶解度约为1×10-4g,故C错误;
D.CaCO3和CaSO4共存的体系中,$\frac{c(S{{O}_{4}}^{2-})}{c(C{{O}_{3}}^{2-})}$=$\frac{\sqrt{Ksp(CaS{O}_{4})}}{\sqrt{Ksp(CaC{O}_{3})}}$=$\frac{9×1{0}^{-6}}{1×1{0}^{-10}}$=9×104,故D正确;
故选C.
点评 本题考查难溶电解质的溶解平衡,为高频考点,把握溶解平衡移动、Ksp的计算、沉淀转化为解答的关键,侧重分析与应用能力的考查,注意选项C中溶解度的计算为解答的难点,题目难度不大.

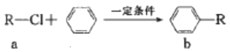 傅克反应是合成芳香族化合物的一种重要方法,有机物a和苯通过傅克反应合成b的过程表示如下(无机小分子产物略去):下列说法中不正确的是( )
傅克反应是合成芳香族化合物的一种重要方法,有机物a和苯通过傅克反应合成b的过程表示如下(无机小分子产物略去):下列说法中不正确的是( )| A. | 该反应是取代反应 | |
| B. | 若R为CH3时,a的电子式为 | |
| C. | 若R为C4H9时,b的结构可能有4种 | |
| D. | 若R为C4H20时,1 mol b最多可与5 mol H2加成 |
| A. | NaOH H2O | B. | NaCl H2O | C. | AgNO3 Ag2O | D. | Na2SO4 H2O |
C(s)+O2 (g)═CO2(g),△H2=-393.5kJ/mol 则 C(s)+CO2(g)=2CO(g) 的△H为( )
| A. | 283kJ•mol-1 | B. | +172.5 kJ•mol-1 | C. | -172.5 kJ•mol-1 | D. | -504 kJ•mol-1 |
 .
.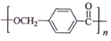 的路线:
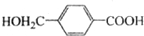
的路线: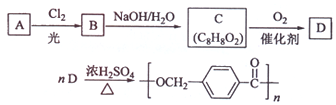
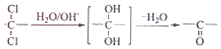
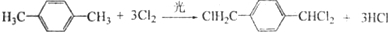 ;
; ,由D合成聚酯类高分子材料
,由D合成聚酯类高分子材料 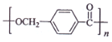 的化学方程式是n
的化学方程式是n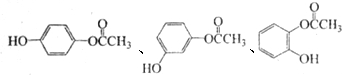 (写结构简式).
(写结构简式).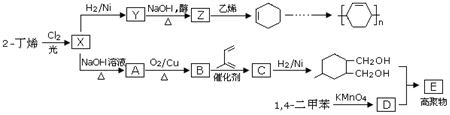
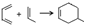 .
.