题目内容
15.pH=a的某电解质溶液中,插入两只惰性电极,通直流电一段时间后,溶液的pH>a,则该电解质可能是( ),添加( )可使该溶液复原.| A. | NaOH H2O | B. | NaCl H2O | C. | AgNO3 Ag2O | D. | Na2SO4 H2O |
分析 pH=a的某电解质溶液中,插入两只惰性电极,通直流电一段时间后,溶液的pH>a,说明电解后溶液的碱性增强;根据离子的放电顺序判断电解实质,根据电解实质判断溶液中氢离子浓度与氢氧根离子浓度的关系结合题意判断选项.
解答 解:A.电解氢氧化钠溶液时,实际上电解的是水,但溶液中的氢氧根离子的浓度增大,pH值增大,若要恢复原溶液要加入水即可,故A正确;
B.电解氯化钠溶液时,阳极上是氯离子失电子得到氯气,阴极上析出氢气,氢离子的浓度减小,氢氧根离子的浓度增大,所以溶液的pH值增大,若要恢复原溶液要加入HCl,故B错误;
C.电解硝酸银溶液时,阴极上析出银,阳极上得到氧气,所以溶液中的氢氧根离子的浓度减小,氢离子的浓度增大,溶液的pH值减小,故C错误;
D.电解硫酸钠溶液时,实际上电解的是水,所以溶液中氢离子和氢氧根离子的相对浓度不变,只是硫酸钠的浓度增大,故pH值不变,故D错误;
故选A.
点评 本题考查了电解原理,题目难度中等,随着电解的进行判断溶液pH值的变化,首先要知道离子的放电顺序、电解的实质,只有明白这些知识点才能正确解答,侧重于考查学生的分析能力和应用能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
3.工业上用化学法除锅炉的水垢时,先向锅炉中注入饱和Na2CO3溶液浸泡,将水垢中的CaSO4转化为CaCO3,再用盐酸除去[已知:Ksp(CaCO3)=1×1010,Ksp(CaSO4)=9×10-6].下列说法错误的是( )
| A. | 温度升高,Na2CO3溶液的Ksp和c(OH-)均会增大 | |
| B. | 沉淀转化的离子方程式为CO32-(aq)+CaSO4(s)?CaCO3(s)+SO42-(aq) | |
| C. | 该条件下,CaCO3的溶解度约为1×10-3g | |
| D. | CaCO3和CaSO4共存的悬浊液中,$\frac{c(S{{O}_{4}}^{2-})}{c(C{{O}_{3}}^{2-})}$=9×104 |
10.下列有关物质的性质与用途具有对应关系的是( )
| A. | 漂白粉在空气中不稳定,可用于漂白纸张 | |
| B. | 氨气具有还原性,可用作制冷剂 | |
| C. | Na2O2呈浅黄色,可用作潜水艇中的供氧剂 | |
| D. | 明矾水解形成Al(OH)3胶体,可用作水处理中的净水剂 |
20. I2在KI溶液中存在平衡:I2(aq)+I-(aq)?I3-(aq),某I2、KI混合溶液中,c($I_3^-$)与温度T的平衡曲线图如图.下列说法不正确的是( )
I2在KI溶液中存在平衡:I2(aq)+I-(aq)?I3-(aq),某I2、KI混合溶液中,c($I_3^-$)与温度T的平衡曲线图如图.下列说法不正确的是( )
 I2在KI溶液中存在平衡:I2(aq)+I-(aq)?I3-(aq),某I2、KI混合溶液中,c($I_3^-$)与温度T的平衡曲线图如图.下列说法不正确的是( )
I2在KI溶液中存在平衡:I2(aq)+I-(aq)?I3-(aq),某I2、KI混合溶液中,c($I_3^-$)与温度T的平衡曲线图如图.下列说法不正确的是( )| A. | 反应I2(aq)+I-(aq)?I3-(aq) 的△H>0 | |
| B. | 若温度为T1、T2,反应的平衡常数分别为 K1、K2,则K1>K2 | |
| C. | 若反应进行到状态D时,一定有v正>v逆 | |
| D. | 状态A与状态B相比,状态A的c (I2) 小 |
7.NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 0.1 mol甲烷含有的电子数为NA | |
| B. | 1L0.1mol/LNa2CO3溶液中含有的CO32-数目为0.1NA | |
| C. | 1mol-OH (羟基)与l molOH-均含有10个NAe- | |
| D. | 标准状况下,2.24LCO和CO2混合气体中含有的氧原子数为0.15NA |
4.二氧化碳和钠在一定条件下可制得金刚石,其化学方程式为3CO2+4Na=2X+C(金刚石).设NA为阿伏加德罗常数的值,下列有关此反应的叙述不正确的是( )
| A. | 金刚石和石墨互为同素异形体 | |
| B. | Na的还原性强于金刚石 | |
| C. | 46g Na完全反应需要标准状况下CO2的体积为33.6L | |
| D. | 当有0.4mo1 Na参与反应时,被还原的CO2的分子数目为0.2NA |
5.下列说法不正确的是( )
| A. | 煤、石油、天然气均为化石燃料,它们属于不可再生资源 | |
| B. | 植物燃料燃烧时放出的能量来源于太阳能 | |
| C. | 氢气是具有热值高、无污染等优点的燃料 | |
| D. | 煤燃烧是化学能只转化为热能的过程 |
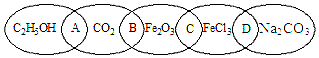
 2-叔丁基对苯二酚是一种重要的食品抗氧剂,现以对苯二酚、叔丁醇为原料,一定条件下经Freidel-Crafts 烷基化反应合成.原理如下:
2-叔丁基对苯二酚是一种重要的食品抗氧剂,现以对苯二酚、叔丁醇为原料,一定条件下经Freidel-Crafts 烷基化反应合成.原理如下: