题目内容
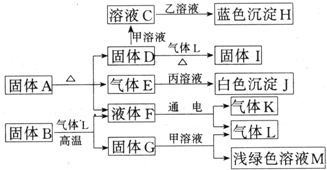
某化学课外活动小组的同学在学习NH3的性质时讨论:既然NH3具有还原性,能否像H2那样还原CuO呢?于是他们设计了如下实验装置(夹持装置未画出)进行实验.

请回答下列问题:
(1)仪器a的名称为 ;仪器b中可选择的试剂为 ;
(2)实验中观察到装置C中黑色CuO粉末变为红色固体,干燥管D增重,量气管内收集到无色无味的单质气体,上述现象可以证明NH3具有 性,写出相应的化学方程式 ;
(3)E装置中浓硫酸的作用是 ;
(4)读取气体体积前,应对装置F进行的操作是: 若读数时,量气管中的液面低于水准管的液面,则量气管中气体的体积将 .(填“偏大”、“偏小”或“不变”).
(5)有同学认为:NH3与CuO反应生成的红色物质中可能含有Cu2O.已知:Cu2O是一种碱性氧化物,在酸性溶液中,Cu+易发生自身的氧化还原反应(2Cu+→Cu+Cu2+).请你设计一个简单的实验检验该红色物质中是否含有Cu2O: .
(6)此套实验装置还可用于测定氨气的分子组成.若实验完毕,测得干燥管D增重m克,装置F测得气体的体积为n升(已折算成标准状况),则氨分子中氮、氢的原子个数比为 (用含m、n字母的代数式表示).

请回答下列问题:
(1)仪器a的名称为
(2)实验中观察到装置C中黑色CuO粉末变为红色固体,干燥管D增重,量气管内收集到无色无味的单质气体,上述现象可以证明NH3具有
(3)E装置中浓硫酸的作用是
(4)读取气体体积前,应对装置F进行的操作是:
(5)有同学认为:NH3与CuO反应生成的红色物质中可能含有Cu2O.已知:Cu2O是一种碱性氧化物,在酸性溶液中,Cu+易发生自身的氧化还原反应(2Cu+→Cu+Cu2+).请你设计一个简单的实验检验该红色物质中是否含有Cu2O:
(6)此套实验装置还可用于测定氨气的分子组成.若实验完毕,测得干燥管D增重m克,装置F测得气体的体积为n升(已折算成标准状况),则氨分子中氮、氢的原子个数比为
考点:性质实验方案的设计
专题:实验设计题
分析:(1)依据装置仪器分析回答,浓氨水滴入锥形瓶中利用固体溶解放热使一水合氨分解生成氨气,需要选择氢氧化钠固体,氧化钙固体或碱石灰;
(2)C中黑色CuO粉末变为红色固体,量气管有无色无味的气体,说明氧化铜做氧化剂氧化氨气生成铜、氮气和水;
(3)E装置中浓硫酸的作用依据装置图分析判断是利用浓硫酸吸收过量氨气,同时避免F装置中的水蒸气进入D;
(4)依据量气管的使用方法回答;
(5)根据已知:Cu2O是一种碱性氧化物,在酸性溶液中,Cu+易发生自身的氧化还原反应(2Cu+→Cu+Cu2+),得出检验该红色物质中是否含有Cu2O的方法;(6)干燥管D增重mg为反应生成的水,装置F测得气体的体积为nL为反应生成的氮气;依据元素守恒计算得到.
(2)C中黑色CuO粉末变为红色固体,量气管有无色无味的气体,说明氧化铜做氧化剂氧化氨气生成铜、氮气和水;
(3)E装置中浓硫酸的作用依据装置图分析判断是利用浓硫酸吸收过量氨气,同时避免F装置中的水蒸气进入D;
(4)依据量气管的使用方法回答;
(5)根据已知:Cu2O是一种碱性氧化物,在酸性溶液中,Cu+易发生自身的氧化还原反应(2Cu+→Cu+Cu2+),得出检验该红色物质中是否含有Cu2O的方法;(6)干燥管D增重mg为反应生成的水,装置F测得气体的体积为nL为反应生成的氮气;依据元素守恒计算得到.
解答:
解:(1)装置中仪器a为分液漏斗;仪器b是利用分液漏斗中滴入的氨水使锥形瓶中的固体溶解放热促进一水合氨分解生成氨气,氢氧化钠固体、氧化钙固体、碱石灰固体,
故答案为:分液漏斗;固体氢氧化钠或氧化钙或碱石灰;
(2)实验中观察到装置C中黑色CuO粉末变为红色固体,量气管有无色无味的气体,说明氨气和氧化铜反应生成铜和氮气与水,氨气被氧化铜氧化表现还原性,结合原子守恒配平写出的化学方程式为3CuO+2NH3
3Cu+3H2O+N2 ,故答案为:还原;3CuO+2NH3
3Cu+3H2O+N2 ;
(3)依据流程分析,浓硫酸是吸收过量的氨气,阻止F中水蒸气进入D影响实验效果,故答案为:吸收未反应的氨气,阻止F中水蒸气进入D;
(4)读取气体体积前,应对装置F进行的操作是慢慢上下移动右边漏斗,使左右两管液面相平,保持压强平衡再读数;量气管中的液面低于水准管的液面,说明内部气压大于大气压,则量气管中气体的体积将偏小,故答案为:慢慢上下移动右边漏斗,使左右两管液面相平,偏小;
(5)根据已知:Cu2O是一种碱性氧化物,在酸性溶液中,Cu+易发生自身的氧化还原反应(2Cu+→Cu+Cu2+),得出检验该红色物质中是否含有Cu2O的方法:取少许样品,加入稀H2SO4(或稀盐酸),若溶液出现蓝色,说明红色物质中含有Cu2O,反之则没有,
故答案为:取少许样品,加入稀H2SO4(或稀盐酸),若溶液出现蓝色,说明红色物质中含有Cu2O,反之则没有;
(6)若测得干燥管D增重mg为水物质的量=
,装置F测得气体的体积为nL(已折算成标准状况)为N2,物质的量=
,依据元素守恒得到氮原子和氢原子物质的量之比=
×2:
×2=
,则氨分子中氮、氢的原子个数比为
,故答案为:
.
故答案为:分液漏斗;固体氢氧化钠或氧化钙或碱石灰;
(2)实验中观察到装置C中黑色CuO粉末变为红色固体,量气管有无色无味的气体,说明氨气和氧化铜反应生成铜和氮气与水,氨气被氧化铜氧化表现还原性,结合原子守恒配平写出的化学方程式为3CuO+2NH3
| ||
| ||
(3)依据流程分析,浓硫酸是吸收过量的氨气,阻止F中水蒸气进入D影响实验效果,故答案为:吸收未反应的氨气,阻止F中水蒸气进入D;
(4)读取气体体积前,应对装置F进行的操作是慢慢上下移动右边漏斗,使左右两管液面相平,保持压强平衡再读数;量气管中的液面低于水准管的液面,说明内部气压大于大气压,则量气管中气体的体积将偏小,故答案为:慢慢上下移动右边漏斗,使左右两管液面相平,偏小;
(5)根据已知:Cu2O是一种碱性氧化物,在酸性溶液中,Cu+易发生自身的氧化还原反应(2Cu+→Cu+Cu2+),得出检验该红色物质中是否含有Cu2O的方法:取少许样品,加入稀H2SO4(或稀盐酸),若溶液出现蓝色,说明红色物质中含有Cu2O,反之则没有,
故答案为:取少许样品,加入稀H2SO4(或稀盐酸),若溶液出现蓝色,说明红色物质中含有Cu2O,反之则没有;
(6)若测得干燥管D增重mg为水物质的量=
| mg |
| 18g/mol |
| nL |
| 22.4L/mol |
| nL |
| 22.4L/mol |
| mg |
| 18g/mol |
| 9n |
| 11.2m |
| 9n |
| 11.2m |
| 9n |
| 11.2m |
点评:本题考查了氨气的实验室制备,性质验证和反应现象分析判断判断,装置流程分析,量气装置的使用方法,测定元素物质的量之比的计算,题目难度中等.

练习册系列答案
相关题目
下列电离方程式书写正确的是( )
| A、CH3COOH═CH3COO-+H+ |
| B、H2O?H++OH- |
| C、NaHCO3?HCO3-+Na+ |
| D、NaHSO4═Na++HSO4- |
 有A、B、C、D四种短周期主族元素,其原子序数依次增大.A、B可形成A2B和A2B2两种化合物,B、C同主族且可形成CB2和CB3两种化合物.完成下列问题.
有A、B、C、D四种短周期主族元素,其原子序数依次增大.A、B可形成A2B和A2B2两种化合物,B、C同主族且可形成CB2和CB3两种化合物.完成下列问题.