题目内容
 有A、B、C、D四种短周期主族元素,其原子序数依次增大.A、B可形成A2B和A2B2两种化合物,B、C同主族且可形成CB2和CB3两种化合物.完成下列问题.
有A、B、C、D四种短周期主族元素,其原子序数依次增大.A、B可形成A2B和A2B2两种化合物,B、C同主族且可形成CB2和CB3两种化合物.完成下列问题.(1)C的名称为
(2)写出A2B的电子式
(3)将CB2通入A2B2溶液中可被氧化为W,试写出该反应的离子方程式
(4)金属元素E是中学化学常见元素,位于元素周期表的第四周期.该元素可与D形成ED2和ED3两种化合物.将E的单质浸入ED3溶液中,溶液由黄色逐渐变为浅绿色,该反应的离子方程式为
(5)请依据(4)中的反应,设计一个原电池.要求:画出实验装置图,注明电解质溶液名称、正负极及正负极材料,并标出电子移动方向,写出电极反应式.
正极反应式:
负极反应式:
考点:位置结构性质的相互关系应用,设计原电池
专题:元素周期律与元素周期表专题,电化学专题
分析:(1)A、B、C、D四种短周期主族元素,其原子序数依次增大,A、B可形成A2B和A2B2两种化合物,可能为H2O、H2O2或Na2O、Na2O2,则A为H元素,B为O元素,B、C同主族且可形成CB2和CB3两种化合物,应为SO2和SO3,则C为S元素,D应为Cl元素,
(2)A2B为H2O,为共价化合物,分子中H原子与O原子之间形成1对共用电子对;
(3)CB2通入A2B2溶液中可被氧化为W,则W为H2SO4;
(4)金属元素E是中学化学常见元素,位于元素周期表的第四周期,该元素可与D形成ED2和ED3两种化合物,则E为Fe元素,Fe与氯化铁反应生成氯化亚铁;
(5)石墨--铁在氯化铁电解质溶液中形成原电池,石墨为正极,Fe3+在正极获得电子生成Fe2+,Fe为负极,发生氧化反应生成Fe2+,电子由负极经导线流向正极.
(2)A2B为H2O,为共价化合物,分子中H原子与O原子之间形成1对共用电子对;
(3)CB2通入A2B2溶液中可被氧化为W,则W为H2SO4;
(4)金属元素E是中学化学常见元素,位于元素周期表的第四周期,该元素可与D形成ED2和ED3两种化合物,则E为Fe元素,Fe与氯化铁反应生成氯化亚铁;
(5)石墨--铁在氯化铁电解质溶液中形成原电池,石墨为正极,Fe3+在正极获得电子生成Fe2+,Fe为负极,发生氧化反应生成Fe2+,电子由负极经导线流向正极.
解答:
解:A、B、C、D四种短周期主族元素,其原子序数依次增大,A、B可形成A2B和A2B2两种化合物,可能为H2O、H2O2或Na2O、Na2O2,则A为H元素,B为O元素,B、C同主族且可形成CB2和CB3两种化合物,应为SO2和SO3,则C为S元素,D应为Cl元素,
(1)由上述分析可知,C为硫元素、D为氯元素,故答案为:硫;氯;
(2)A2B为H2O,为共价化合物,分子中H原子与O原子之间形成1对共用电子对,其电子式为: ,故答案为:
,故答案为: ;
;
(3)CB2通入A2B2溶液中可被氧化为W,则W为H2SO4,该反应离子方程式为:SO2+H2O2=2H++SO42-,故答案为:SO2+H2O2=2H++SO42-;
(4)金属元素E是中学化学常见元素,位于元素周期表的第四周期,该元素可与D形成ED2和ED3两种化合物,则E为Fe元素,Fe与氯化铁反应生成氯化亚铁,该反应离子方程式为:Fe+2Fe3+=3Fe2+,故答案为:Fe+2Fe3+=3Fe2+;
(5)石墨--铁在氯化铁电解质溶液中形成原电池,石墨为正极,Fe3+在正极上得电子被还原,电极反应式为:2Fe3++2e-=2Fe2+,铁做负极,电极反应式为Fe-2e-=Fe2+,电子由负极经导线流向正极,该原电池装置图为: ,
,
故答案为:Fe-2e-=Fe2+;2Fe3++2e-=2Fe2+; .
.
(1)由上述分析可知,C为硫元素、D为氯元素,故答案为:硫;氯;
(2)A2B为H2O,为共价化合物,分子中H原子与O原子之间形成1对共用电子对,其电子式为:
 ,故答案为:
,故答案为: ;
;(3)CB2通入A2B2溶液中可被氧化为W,则W为H2SO4,该反应离子方程式为:SO2+H2O2=2H++SO42-,故答案为:SO2+H2O2=2H++SO42-;
(4)金属元素E是中学化学常见元素,位于元素周期表的第四周期,该元素可与D形成ED2和ED3两种化合物,则E为Fe元素,Fe与氯化铁反应生成氯化亚铁,该反应离子方程式为:Fe+2Fe3+=3Fe2+,故答案为:Fe+2Fe3+=3Fe2+;
(5)石墨--铁在氯化铁电解质溶液中形成原电池,石墨为正极,Fe3+在正极上得电子被还原,电极反应式为:2Fe3++2e-=2Fe2+,铁做负极,电极反应式为Fe-2e-=Fe2+,电子由负极经导线流向正极,该原电池装置图为:
 ,
,故答案为:Fe-2e-=Fe2+;2Fe3++2e-=2Fe2+;
 .
.
点评:本题考查元素推断和原电池、常用化学用语,题目难度中等,注意正确推断元素的种类为解答该题的关键,注意原电池装置图的绘画.

练习册系列答案
 全能练考卷系列答案
全能练考卷系列答案 一课一练课时达标系列答案
一课一练课时达标系列答案
相关题目
我们生活中离不开各种各样的电池,下列关于电池的说法错误的是( )
| A、用后不能再生的电池称为一次电池,如锌锰干电池(电解质溶液中含氯化铵等) |
| B、放电后通过充电可反复使用的电池称为二次电池,如镍镉电池、铅蓄电池等 |
| C、手机、电脑、数码相机中的可充电电池使用寿命长,对环境无害,不用进行回收 |
| D、目前我国生产的无汞干电池,对环境和人体健康没有明显危害,可以不进行特殊处理,和普通垃圾混放 |
关于钠元素的单质及其化合物的叙述不正确的是( )
| A、钠:银白色,质软,熔点低,密度比水小 |
| B、钠着火时可以用沙子盖灭,少量的钠可保存在煤油中 |
| C、金属钠在空气中长期放置,最终变为碳酸钠 |
| D、氧化钠和过氧化钠都是白色固体,都是碱性氧化物 |
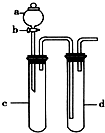 铜与稀硝酸反应产生NO,NO又被氧化成NO2,对实验观察无色NO有干扰,过多的NO、NO2又会污染环境.改进实验的设计符合绿色化学的思想.某兴趣小组设计出下图所示装置置来改进教材中“铜与硝酸反应”的实验,以探究化学实验的绿色化.
铜与稀硝酸反应产生NO,NO又被氧化成NO2,对实验观察无色NO有干扰,过多的NO、NO2又会污染环境.改进实验的设计符合绿色化学的思想.某兴趣小组设计出下图所示装置置来改进教材中“铜与硝酸反应”的实验,以探究化学实验的绿色化.
 (1)pH=13的CH3COONa溶液加水稀释100倍后,pH
(1)pH=13的CH3COONa溶液加水稀释100倍后,pH