题目内容
(1)写出下列反应的化学方程式:
①苯与浓硝酸、浓硫酸的混合物反应(60℃): .
②乙烯与苯在催化剂加热条件下反应: .
(2)某有机分子结构如下:
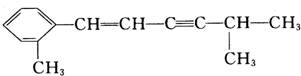
该分子中最多有 个C原子共处同一平面
(3)将C8H18完全裂化,生成的产物中只有C4H8、CH4、C3H6、C2H6、C2H4,则气体产物的平均相对分子量取值范围为 .
(4)400K、101.3kPa时,1.5L某烃蒸气能在aL氧气中完全燃烧,体积增大至(a+3)L(相同条件下).该烃在组成上必须满足的基本条件是 .
①苯与浓硝酸、浓硫酸的混合物反应(60℃):
②乙烯与苯在催化剂加热条件下反应:
(2)某有机分子结构如下:
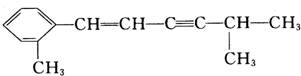
该分子中最多有
(3)将C8H18完全裂化,生成的产物中只有C4H8、CH4、C3H6、C2H6、C2H4,则气体产物的平均相对分子量取值范围为
(4)400K、101.3kPa时,1.5L某烃蒸气能在aL氧气中完全燃烧,体积增大至(a+3)L(相同条件下).该烃在组成上必须满足的基本条件是
考点:有机物的结构和性质,化学方程式的有关计算,常见有机化合物的结构,有机化学反应的综合应用
专题:计算题,有机化学基础
分析:(1)①苯与浓硝酸、浓硫酸的混合物发生取代反应生成硝基苯;
②乙烯与苯在催化剂加热条件下发生加成反应生成苯乙烷;
(2)苯环、碳碳双键为平面结构,碳碳三键为直线结构,以此分析;
(3)根据C原子、H原子守恒,判断C8H18裂化可能发生的反应情况,根据反应情况判断1molC8H18裂化所得的混合气体的物质的量的范围,再根据极限法计算平均相对分子质量的范围;
(4)400K水为气体,设烃为CxHy,由CxHy+(x+
)O2
xCO2+
H2O,利用气体体积差量计算.
②乙烯与苯在催化剂加热条件下发生加成反应生成苯乙烷;
(2)苯环、碳碳双键为平面结构,碳碳三键为直线结构,以此分析;
(3)根据C原子、H原子守恒,判断C8H18裂化可能发生的反应情况,根据反应情况判断1molC8H18裂化所得的混合气体的物质的量的范围,再根据极限法计算平均相对分子质量的范围;
(4)400K水为气体,设烃为CxHy,由CxHy+(x+
| y |
| 4 |
| 点燃 |
| y |
| 2 |
解答:
解:(1)①苯与浓硝酸、浓硫酸的混合物发生取代反应生成硝基苯,反应的方程式为 ,
,
故答案为: ;
;
②乙烯与苯在催化剂加热条件下发生加成反应生成苯乙烷,反应为 ,
,
故答案为: ;
;
(2)苯环、碳碳双键为平面结构,碳碳三键为直线结构,则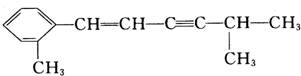 中与苯环相连的C、苯环上6个C、碳碳双键中的2个C、碳碳三键中的2个C及CH中的C一定共面,由CH上的C为四面体构型,可3个原子共面,则2个甲基中由1个C与前面12个C原子共面,即最多13个C原子共面,
中与苯环相连的C、苯环上6个C、碳碳双键中的2个C、碳碳三键中的2个C及CH中的C一定共面,由CH上的C为四面体构型,可3个原子共面,则2个甲基中由1个C与前面12个C原子共面,即最多13个C原子共面,
故答案为:13;
(3)按照题目所给C8H18的裂化产物考虑,C8H18裂化可能发生的反应共有以下几种:
①C8H18→C4H8+C3H6+CH4
②C8H18→C4H8+C2H4+C2H6
③C8H18→2C3H6+C2H6
④C8H18→C3H6+2C2H4+CH4
⑤C8H18→3C2H4+C2H6
以上反应①、②、③是1molC8H18裂化生成3mol混合气体;④、⑤反应是1molC8H18裂化生成4mol混合气体.要得到题目所述的混合气体,按①、②、③反应就可以实现;但是按④、⑤反应并不能得到题目所述的混合气体,至少需要①、②中的一个反应参与或者共同参与,③也有可能同时参与.
这样1molC8H18裂化所得的混合气体的物质的量为3mol≤n<4mol,所以混合气体的平均摩尔质量
<
≤
,
即平均相对分子质量为28.5<Mr≤38,
故答案为:28.5<M≤38;
(4)400K水为气体,设烃为CxHy,由CxHy+(x+
)O2
xCO2+
H2O,
由CxHy+(x+
)O2
xCO2+
H2O△V
1 x+
x
-1
1.5L (a+3-a-1.5)L=1.5L
则
-1=1,解得y=8,该烃在组成上必须满足的基本条件是CxH8,
故答案为:CxH8.
 ,
,故答案为:
 ;
;②乙烯与苯在催化剂加热条件下发生加成反应生成苯乙烷,反应为
 ,
,故答案为:
 ;
;(2)苯环、碳碳双键为平面结构,碳碳三键为直线结构,则
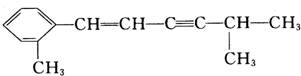 中与苯环相连的C、苯环上6个C、碳碳双键中的2个C、碳碳三键中的2个C及CH中的C一定共面,由CH上的C为四面体构型,可3个原子共面,则2个甲基中由1个C与前面12个C原子共面,即最多13个C原子共面,
中与苯环相连的C、苯环上6个C、碳碳双键中的2个C、碳碳三键中的2个C及CH中的C一定共面,由CH上的C为四面体构型,可3个原子共面,则2个甲基中由1个C与前面12个C原子共面,即最多13个C原子共面,故答案为:13;
(3)按照题目所给C8H18的裂化产物考虑,C8H18裂化可能发生的反应共有以下几种:
①C8H18→C4H8+C3H6+CH4
②C8H18→C4H8+C2H4+C2H6
③C8H18→2C3H6+C2H6
④C8H18→C3H6+2C2H4+CH4
⑤C8H18→3C2H4+C2H6
以上反应①、②、③是1molC8H18裂化生成3mol混合气体;④、⑤反应是1molC8H18裂化生成4mol混合气体.要得到题目所述的混合气体,按①、②、③反应就可以实现;但是按④、⑤反应并不能得到题目所述的混合气体,至少需要①、②中的一个反应参与或者共同参与,③也有可能同时参与.
这样1molC8H18裂化所得的混合气体的物质的量为3mol≤n<4mol,所以混合气体的平均摩尔质量
| 1mol×114g/mol |
| 4mol |
. |
| M |
| 1mol×114g/mol |
| 3mol |
即平均相对分子质量为28.5<Mr≤38,
故答案为:28.5<M≤38;
(4)400K水为气体,设烃为CxHy,由CxHy+(x+
| y |
| 4 |
| 点燃 |
| y |
| 2 |
由CxHy+(x+
| y |
| 4 |
| 点燃 |
| y |
| 2 |
1 x+
| y |
| 4 |
| y |
| 2 |
| y |
| 4 |
1.5L (a+3-a-1.5)L=1.5L
则
| y |
| 4 |
故答案为:CxH8.
点评:本题考查较综合,涉及有机物结构与性质、有机反应方程式的书写、混合物的计算等,侧重分析能力、计算能力的综合考查,综合性较强,题目难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
Al、Fe、Cu都是重要的金属元素.下列说法正确的是( )
| A、三者的单质放置在潮湿的空气中均只生成氧化物 |
| B、制备AlCl3、FeCl3、CuCl2均可用两种单质直接化合的方法 |
| C、三者对应的氧化物均为碱性氧化物 |
| D、三者对应的氢氧化物均可由其对应的氧化物加水生成 |

 草酸(H2C2O4)是一种易溶于水的二元中强酸,在水中它的存在形态有H2C2O4、HC2O4-、C2O42-,各形态的分布系数(浓度分数)α随溶液pH变化的关系如图所示:
草酸(H2C2O4)是一种易溶于水的二元中强酸,在水中它的存在形态有H2C2O4、HC2O4-、C2O42-,各形态的分布系数(浓度分数)α随溶液pH变化的关系如图所示: