题目内容
4.如图各烧杯中都是天然水,纯铁腐蚀由快到慢的顺序是( )
| A. | ⑤②①④③ | B. | ③②⑤④① | C. | ⑤④②③① | D. | ⑤②①③④ |
分析 先判断装置是原电池还是电解池,再根据原电池正负极腐蚀的快慢比较,作原电池负极和电解池阳极的金属易被腐蚀,作原电池正极或电解池阴极的金属易被保护,金属腐蚀快慢顺序是:电解原理引起的腐蚀>原电池原理引起的腐蚀>化学腐蚀>有防护腐蚀措施的腐蚀.
解答 解:根据图知,②③装置是原电池,在②中,金属铁做负极,③中金属铁作正极,做负极的腐蚀速率快,并且两个电极金属活泼性相差越大,负极金属腐蚀速率越快,正极被保护,所以②>③,
④⑤装置是电解池,④中金属铁为阴极,⑤中金属铁为阳极,阳极金属被腐蚀速率快,阴极被保护,即⑤>④,
根据电解原理引起的腐蚀>原电池原理引起的腐蚀>化学腐蚀>有防护腐蚀措施的腐蚀,并且原电池的正极金属腐蚀速率快于电解池的阴极金属腐蚀速率,
所以铁腐蚀快慢顺序为:⑤②①③④;
故选D.
点评 本题考查了金属的腐蚀与防护,明确原电池和电解池原理是解本题关键,知道作原电池负极或电解池阳极的金属易被腐蚀,难度不大.

练习册系列答案
相关题目
12.设NA代表阿伏加德罗常数的值,下列有关叙述正确的是( )
| A. | 电解精炼铜时,若阳极质量减少6.4 g,则电路中转移电子数为0.2NA | |
| B. | 标准状况下,44.8 L NO与22.4 L O2混合后气体中分子总数等于2NA | |
| C. | NO2和H2O反应每生成2 mol HNO3时转移的电子数目为2NA | |
| D. | 1 mol Fe在氧气中充分燃烧失去3NA个电子 |
19. 某有机物的结构简式如图,取Na、NaOH、新制Cu(OH)2分别与等物质的量的该物质恰好反应(反应时可加热煮沸)则Na、NaOH、新制Cu(OH)2三种物质的物质的量之比为( )
某有机物的结构简式如图,取Na、NaOH、新制Cu(OH)2分别与等物质的量的该物质恰好反应(反应时可加热煮沸)则Na、NaOH、新制Cu(OH)2三种物质的物质的量之比为( )
 某有机物的结构简式如图,取Na、NaOH、新制Cu(OH)2分别与等物质的量的该物质恰好反应(反应时可加热煮沸)则Na、NaOH、新制Cu(OH)2三种物质的物质的量之比为( )
某有机物的结构简式如图,取Na、NaOH、新制Cu(OH)2分别与等物质的量的该物质恰好反应(反应时可加热煮沸)则Na、NaOH、新制Cu(OH)2三种物质的物质的量之比为( )| A. | 6:4:5 | B. | 4:6:5 | C. | 2:3:2 | D. | 2:1:2 |
16.下列化学式可以代表一种物质的是( )
| A. | C | B. | CH2Cl2 | C. | C2H6O | D. | C2H4Cl2 |
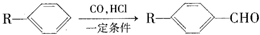 为合成某种液晶材料的中间体M,有人提出如下不同的合成路径:
为合成某种液晶材料的中间体M,有人提出如下不同的合成路径: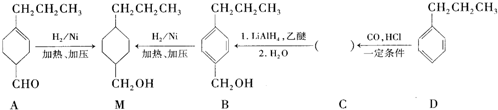
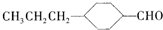 和
和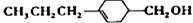 (写结构简式)生成.
(写结构简式)生成.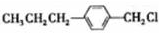 .
. .
. 是一种医药中间体,常用来制备抗凝血药,可通过下列路线合成:
是一种医药中间体,常用来制备抗凝血药,可通过下列路线合成:
 .
. .
.