题目内容
9.用下列实验装置进行相应的实验,能够达到实验目的是( )| A. | 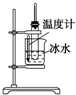 实验室制取少量的硝基苯 | |
| B. | 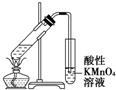 证明溴乙烷、NaOH、乙醇溶液共热生成乙烯 | |
| C. | 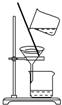 分离乙酸乙酯、碳酸钠和水的混合物 | |
| D. | 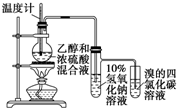 证明乙醇、浓硫酸共热生成乙烯 |
分析 A.制备硝基苯应水浴加热;
B.溴乙烷、NaOH、乙醇溶液发生消去反应生成乙烯,但乙醇挥发,乙醇也能被高锰酸钾氧化;
C.乙酸乙酯、碳酸钠和水的混合物,分层,乙酸乙酯在上层;
D.乙醇和浓硫酸混合加热到170°C发生消去反应生成乙烯,过程中副反应为浓硫酸脱水性得到碳和浓硫酸加热反应生成二氧化碳和二氧化硫,二氧化硫具有还原性和溴单质发生反应,检验乙烯前需要除去二氧化硫.
解答 解:A.制备硝基苯应水浴加热,温度计测定水温度,加热至50℃~60℃,故A错误;
B.溴乙烷、NaOH、乙醇溶液发生消去反应生成乙烯,但乙醇挥发,乙醇也能被高锰酸钾氧化,不能说明乙烯的生成,故B错误;
C.乙酸乙酯、碳酸钠和水的混合物,分层,乙酸乙酯在上层,则利用分液法分离,不能利用过滤分离,故C错误;
D.乙醇和浓硫酸混合加热到170°C发生消去反应生成乙烯,过程中副反应为浓硫酸脱水性得到碳和浓硫酸加热反应生成二氧化碳和二氧化硫,二氧化硫具有还原性和溴单质发生反应,检验乙烯前需要除去二氧化硫,装置中乙烯发生装置正确,通过氢氧化钠溶液吸收生成的二氧化硫和二氧化碳,剩余气体通过溴的四氯化碳溶液褪色证明生成乙烯,实验装置能够达到实验目的,故D正确;
故选D.
点评 本题考查化学实验方案的评价,为高频考点,涉及有机物的制备、混合物分离提纯、物质检验实验等,把握反应原理及实验技能为解答的关键,侧重实验基本技能的考查,注意实验的评价性分析,题目难度中等.

练习册系列答案
 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案
相关题目
20.在基态多电子原子中,关于核外电子能量的叙述错误的是( )
| A. | 最易失去的电子能量最高 | |
| B. | 电离能最小的电子能量最高 | |
| C. | 2p轨道电子能量高于2s轨道电子能量 | |
| D. | 在离核最近区域内运动的电子能量最高 |
17.下表是元素周期表的一部分,据表中的①~⑨种元素填写下列空白:(填具体元素相应的符号).
(1)在这些元素中,化学性质最不活泼的是:Ar
(2)在最高价氧化物的水化物中,酸性最强的化合物的分子式是HClO4,碱性最强的化合物的电子式是: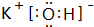 .
.
(3)写出元素①对应的最高价氧化物的结构式为O=C=O该氧化物的晶体中含有的作用力是 (填离子键或共价键或分子间作用力)共价键、分子间作用力
(4)①②③⑥这四种元素对应的简单氢化物沸点最高的是H2O>NH3>H2S>CH4
(5)③④⑤⑥这四种元素对应的离子半径由大到小的顺序S2->O2->Na+>Al3+.
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ |
(2)在最高价氧化物的水化物中,酸性最强的化合物的分子式是HClO4,碱性最强的化合物的电子式是:
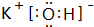 .
.(3)写出元素①对应的最高价氧化物的结构式为O=C=O该氧化物的晶体中含有的作用力是 (填离子键或共价键或分子间作用力)共价键、分子间作用力
(4)①②③⑥这四种元素对应的简单氢化物沸点最高的是H2O>NH3>H2S>CH4
(5)③④⑤⑥这四种元素对应的离子半径由大到小的顺序S2->O2->Na+>Al3+.
4.短周期的两种元素A和B,它们的离子A-和B2+具有相同的电子层结构,下列说法中正确的是( )
| A. | 原子序数A>B | B. | 电子总数A->B2+ | C. | 离子半径A->B2+ | D. | 原子半径A>B |
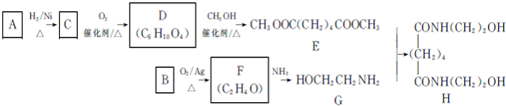
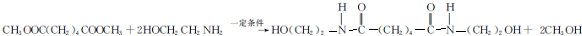 .
.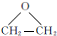 ,能发生银镜反应的F的同分异构体是CH3CHO.
,能发生银镜反应的F的同分异构体是CH3CHO.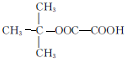 (写结构简式).
(写结构简式).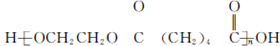 的合成路线:
的合成路线: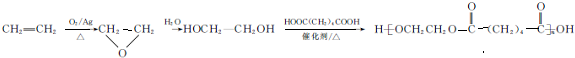 .
.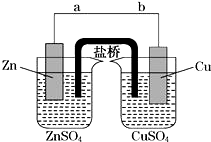 某学生利用如图实验装置探究盐桥式原电池的工作原理(Cu元素的相对原子质量为64).按照实验步骤依次回答下列问题:
某学生利用如图实验装置探究盐桥式原电池的工作原理(Cu元素的相对原子质量为64).按照实验步骤依次回答下列问题:
 、
、 、
、 .(不包括A,写结构简式)
.(不包括A,写结构简式) ;反应类型是酯化反应.
;反应类型是酯化反应. +2NaOH$\stackrel{△}{→}$
+2NaOH$\stackrel{△}{→}$ +
+ +H2O
+H2O 任意一种.
任意一种. ;
;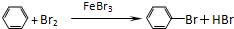 ;
;