题目内容
17.硼(B)元素有2种天然核素:10B和 11B,又知硼(B)元素的平均相对原子质量为10.8,求硼元素的2种天然核素的原子个数比.分析 元素相对原子质量=各同位素相对原子质量与其物质的量含量的乘积之和.据此分析计算.
解答 解:设10B的原子个数为a,则11B的原子个数为b,则:10×$\frac{a}{a+b}$+11×$\frac{b}{a+b}$=10.8,整理可得a:b=1:4,即10B与11B的原子数目之比为1:4.
答:10B与11B的原子数目之比为1:4.
点评 本题考查物质的量及相对分子质量的计算,利用十字相乘法计算更为简单,注意元素相对原子质量的计算,题目较简单.

练习册系列答案
 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案
相关题目
7.下列物质,是强电解质的是( )
| A. | 硫酸钠 | B. | 石墨 | C. | 稀H2SO4 | D. | CO2 |
8.用石墨作电极,电解质溶液中各离子浓度之比如下:
c(Cu2+):c(Na+):c(Cl-)═1:2:4.在任何情况下,阴、阳两极不可能同时发生反应的是( )
c(Cu2+):c(Na+):c(Cl-)═1:2:4.在任何情况下,阴、阳两极不可能同时发生反应的是( )
| A. | 阴极:2H++2e-═H2↑阳极:4OH--4e-═O2↑+2H2O | |
| B. | 阴极:Cu2++2e-═Cu 阳极:4OH--4e-═O2↑+2H2O | |
| C. | 阴极:2H++2e-═H2↑ 阳极:2Cl--2e-═Cl2↑ | |
| D. | 阴极:Cu2++2e-═Cu 阳极:2Cl--2e-═Cl2↑ |
10.图是周期表的一部分,A、B、C、D、
4种元素的原子核外共含有48个质子,A、B、C为第三周期元素.
(1)B、C、D的元素符号分别是:BSi,CP,DC
(2)写出A离子的结构示意图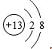
(3)E位于元素周期表的第四周期、第IVA族
(4)B元素属于非金属元素(填“金属”或“非金属”),A元素最高价氧化物属于两性氧化物(填“碱性”、“酸性”或“两性”)
| D | ||
| A | B | C |
| E |
(1)B、C、D的元素符号分别是:BSi,CP,DC
(2)写出A离子的结构示意图
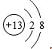
(3)E位于元素周期表的第四周期、第IVA族
(4)B元素属于非金属元素(填“金属”或“非金属”),A元素最高价氧化物属于两性氧化物(填“碱性”、“酸性”或“两性”)
 .
.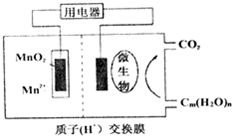 关于如图微生物燃料电池结构示意图的说法:
关于如图微生物燃料电池结构示意图的说法: