题目内容
下列事实所对应的方程式不正确的是( )
| A、盛放氢氧化钠溶液的试剂瓶不能用玻璃塞:SiO2+2NaOH═Na2SiO3+H2O | ||||
B、高温下铁与水蒸气反应生成保护膜:2Fe+6H2O(g)
| ||||
| C、工业制取漂粉精:2Cl2+2Ca(OH)2═CaCl2+Ca(ClO)2+2H2O | ||||
| D、实验室制取氨气:2NH4Cl+Ca(OH)2═CaCl2+2NH3↑+2H2O |
考点:离子方程式的书写
专题:阿伏加德罗常数和阿伏加德罗定律
分析:A.二氧化硅能与氢氧化钠反应生成硅酸钠;
B.高温下铁与水蒸气反应生成四氧化三铁;
C.漂粉精的主要成分是次氯酸钙;
D.实验室用加热固体氯化铵和熟石灰制取氨气.
B.高温下铁与水蒸气反应生成四氧化三铁;
C.漂粉精的主要成分是次氯酸钙;
D.实验室用加热固体氯化铵和熟石灰制取氨气.
解答:
解:A.二氧化硅能与氢氧化钠反应生成硅酸钠,硅酸钠能粘合玻璃,故A正确;
B.高温下铁与水蒸气反应生成保护膜:3Fe+4H2O
Fe3O4+4H2,故B错误;
C.用氯气和熟石灰制取漂粉精,氯气和熟石灰[Ca(OH)2]反应的化学方程式:2Cl2+2Ca(OH)2═CaCl2+Ca(ClO)2+2H2O,故C正确;
D.实验室用加热固体氯化铵和熟石灰制取氨气2NH4Cl+Ca(OH)2
CaCl2+2NH3↑+2H2O,故D正确.
故选B.
B.高温下铁与水蒸气反应生成保护膜:3Fe+4H2O
| ||
C.用氯气和熟石灰制取漂粉精,氯气和熟石灰[Ca(OH)2]反应的化学方程式:2Cl2+2Ca(OH)2═CaCl2+Ca(ClO)2+2H2O,故C正确;
D.实验室用加热固体氯化铵和熟石灰制取氨气2NH4Cl+Ca(OH)2
| ||
故选B.
点评:本题考查化学方程式的书写,难度不大,明确发生的化学反应是解答本题的关键.

练习册系列答案
 活力课时同步练习册系列答案
活力课时同步练习册系列答案
相关题目
Li-Al/FeS电池是一种正在开发的车载电池,该电池中正极的电极反应式为:2Li++FeS+2e-=Li2S+Fe 有关该电池的下列叙述中,正确的是( )
| A、负极的电极反应式为Li-e-=Li+ |
| B、该电池的电解质溶液可以用稀硫酸 |
| C、电池内部Li+向负极移动 |
| D、充电时,阴极发生的电极反应式为:Li2S+Fe-2e-═2Li++FeS |
在下列下列说法正确的是( )
| A、加入铝粉生成H2的溶液中,K+、Cu2+、SO42-、ClO-能大量共存 |
| B、在c(OH-)=10-2 mol?L-1的溶液中,NO3-、Ba2+、Cl-、Br-能大量共存 |
| C、0.1 mol/L Na2CO3溶液中:c(Na+)>c(CO32-)>c(OH-)>c(HCO3-)>c(H+) |
| D、0.1 mol/L Na2CO3溶液中:2c(Na+)=c(H2CO3)+c(CO32-)+c(HCO3-) |
在下列溶液中,可能大量共存的离子组是( )
A、使石蕊试液变红的溶液:Na+、K+、NO
| ||||
B、常温下,由水电离出的c(H+)=10-14mo1?L-1的溶液:K+、Na+、HCO
| ||||
C、与铝反应放出氢气的溶液:K+、A13+、SO
| ||||
D、含有大量Fe3+的溶液:Na+、Mg2+、NO
|
常温下,下列各溶液中微粒的物质的量浓度关系正确的是( )
| A、将pH=6的H2SO4 稀释1000倍后,c(H+)=2c(SO42-) |
| B、0.1mol?L-1的Na2CO3溶液中:c(OH- )=c(HCO3- )+c(H+)+c(H2CO3) |
| C、浓度均为0.1mol?L-1的NaClO溶液和CH3COONa溶液中,c(ClO-)<c(CH3COO-) |
| D、浓度分别为0.1mol?L-1和0.01mol?L-1的CH3COOH溶液中:c(CH3COO-)前者是后者的10倍 |
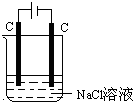 图为电解饱和食盐水示意图,下列说法正确的是( )
图为电解饱和食盐水示意图,下列说法正确的是( )| A、阳上析出氢气 |
| B、阴极上发生氧化反应 |
| C、电解时,溶液的pH增大 |
| D、与电源正极相连的是电解池的阴极 |