题目内容
3.已知:Cu+4HNO3(浓)═Cu(NO3)2+2NO2↑+2H2O3Cu+8HNO3(稀)═3Cu(NO3)2+2NO↑+4H2O
将2.56g铜放入14mL浓硝酸中,随着铜的不断减少,反应生成的气体颜色逐渐变浅.当铜片完全消失时,收集到干燥的NO、NO2混合气体,换算成标准状况下体积为1.344L(忽略气体的溶解及转化).请回答下列问题:
(1)反应中被还原的HNO3的物质的量是0.06mol.
(2)生成气体中NO与NO2的体积比是1:5
(3)该浓HNO3的物质的量浓度≥10mol•L-1.
分析 发生反应为:Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O,3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O,n(Cu)=$\frac{2.56g}{64g/mol}$=0.04mol,换算成标准状况下体积为1.344L,物质的量为$\frac{1.344L}{22.4L/mol}$=0.06mol,结合原子守恒及反应计算.
解答 解:设NO与NO2的物质的量分别为xmol和ymol,则$\left\{\begin{array}{l}{x+y=0.06mol}\\{3x+y=0.04mol×2}\end{array}\right.$,解之得:$\left\{\begin{array}{l}{x=0.01mol}\\{y=0.05mol}\end{array}\right.$,该浓HNO3的物质的量大于等于0.06mol+0.04×2=0.14mol,所以物质的量浓度应大于$\frac{0.14mol}{0.014L}$=10mol/L
故答案为:(1)反应中被还原的HNO3的物质的量等于氮的氧化物的物质的量,所以被还原的HNO3的物质为0.06mol;
(2)生成气体中NO与NO2的体积比等于物质的量之比:0.01:0.05=1:5;
(3)该浓HNO3的物质的量浓度≥10mol/L.
点评 本题考查化学反应方程式的计算,为高频考点,把握原子守恒和电子守恒为解答的关键,侧重分析能力、计算能力的考查,题目难度不大.

练习册系列答案
 阶梯计算系列答案
阶梯计算系列答案
相关题目
14.下列物质对应的电子式书写正确的是( )
| A. | NH4Br: | B. | CaCl2: | C. | N2:N??N | D. | Na2O2: |
11.已知:Na2O2+CO2→Na2CO3+O2(未配平),关于该反应的说法中正确的是( )
| A. | 生成0.1 mol O2转移0.4mol电子 | |
| B. | 相同条件下足量Na2O2吸收10LCO2放出5LCO2 | |
| C. | 氧化剂是Na2O2,还原剂是CO2 | |
| D. | 在Na2O2+SO2═Na2SO4的反应中,SO2的作用跟CO2相同 |
18. 下列各组物质中不能按如图所示的关系一步转化的是( )
下列各组物质中不能按如图所示的关系一步转化的是( )
 下列各组物质中不能按如图所示的关系一步转化的是( )
下列各组物质中不能按如图所示的关系一步转化的是( )| 选项 | 甲 | 乙 | 丙 | 丁 |
| A | S | SO2 | SO3 | H2SO4 |
| B | Al | Al2O3 | AlCI3 | Al(OH)3 |
| C | Na | Na2O2 | Na2CO3 | NaOH |
| D | Si | SiO2 | Na2SO3 | H2SiO3 |
| A. | A | B. | B | C. | C | D. | D |
15.下列离子方程式书写正确的是( )
| A. | AgNO3溶液中滴入少量的Na2S溶液 2Ag NO3+S2-=Ag2S↓+2NO3- | |
| B. | 过量CO2通入Ca(ClO)2溶液中 ClO-+CO2+H2O=HCO3-+HClO | |
| C. | 向Na2CO3溶液中加入过量CH3COOH溶液 CO32-+2H+=CO2↑+H2O | |
| D. | 向Ba(OH)2溶液中加入少量NaHCO3溶液 2HCO3-+Ba2++2OH-=BaCO3↓+CO32-+2H2O |
12.鉴别苯酚溶液、己烷、己烯、乙酸溶液和乙醇液体,可选用的最佳试剂是( )
| A. | 溴水、Cu(OH)2 | B. | FeCl3溶液、金属钠、溴水、石蕊试液 | ||
| C. | 石蕊试液、溴水 | D. | KMnO4酸性溶液、石蕊试液 |
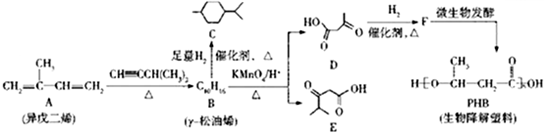
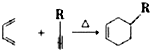
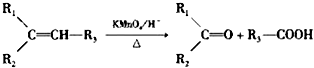
 .反应类型为加成反应或还原反应.
.反应类型为加成反应或还原反应.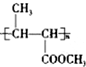 的合成路线
的合成路线 .
.