题目内容
13.在由水电离出的c(OH-)=1×10-13 mol/L的溶液中,可能大量共存的离子组是( )| A. | Fe2+ Na+ NO3- Cl- | B. | Ba2+ Cu2+ NO${\;}_{3}^{-}$ Cl- | ||
| C. | SO42- SO3- NH4+ Na+ | D. | Mg2+ Na+ Br- ClO- |
分析 由水电离出的c(OH-)=1×10-13 mol/L的溶液中存在大量氢离子或氢氧根离子,
A.硝酸根离子在酸性条件下能够氧化亚铁离子;
B.四种离子之间不反应,都不与氢离子、氢氧根离子反应;
C.亚硫酸根离子与氢离子反应,铵根离子与氢氧根离子反应;
D.镁离子与次氯酸根离子发生双水解反应,镁离子与氢氧根离子反应,次氯酸根离子与氢离子反应.
解答 解:由水电离出的c(OH-)=1×10-13 mol/L的溶液为酸性或碱性溶液,溶液中存在大量氢离子或氢氧根离子,
A.Fe2+、NO3-在酸性条件下发生氧化还原反应,在溶液中不能大量共存,故A错误;
B.Ba2+、Cu2+、NO3-、Cl-之间不发生反应,都不与氢离子、氢氧根离子反应,在溶液中能够大量共存,故B正确;
C.SO3-与氢离子反应,NH4+与氢氧根离子反应,在溶液中不能大量共存,故C错误;
D.Mg2+、ClO-之间发生双水解反应,Mg2+与氢氧根离子反应,ClO-与氢离子反应,在溶液中不能大量共存,故D错误;
故选B.
点评 本题考查离子共存的判断,为高考的高频题,属于中等难度的试题,注意明确离子不能大量共存的一般情况,如:能发生复分解反应的离子之间;能发生氧化还原反应的离子之间;能发生络合反应的离子之间(如 Fe3+和 SCN-)等;还应该注意题目所隐含的条件,如:溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-;是“可能”共存,还是“一定”共存等.

练习册系列答案
相关题目
4.下表中的实验操作能达到实验目的是( )
| 选项 | 实验操作 | 实验目的 |
| A | 将浓硫酸和碳单质混合加热,直接将生成的气体通入足量的澄清石灰水,石灰水变浑浊 | 检验气体产物中CO2的存在 |
| B | 将NaOH的乙醇溶液加入溴乙烷中,加热,将产生的气体直接通入到酸性高锰酸钾溶液中,溶液褪色 | 证明溴乙烷的消去反应有乙烯生成 |
| C | 先滴入Ba(NO3)2溶液,产生沉淀,加入足量稀盐酸,仍有沉淀 | 检验溶液中是否含有SO42- |
| D | 常温下测定物质的量浓度相同的盐酸和醋酸溶液的pH:盐酸pH小于醋酸pH | 证明相同条件下,在水中HCl电离程度大于CH3COOH |
| A. | A | B. | B | C. | C | D. | D |
8.硫酸性质是中学化学学习的重点.请回答下列问题:
(1)中学化学中利用物质与浓硫酸共热可制备SO2气体,写出用浓硫酸还可制备不同类别的气体的名称:乙烯(写一种).
(2)某化学兴趣小组为探究铜与浓硫酸的反应以及SO2的性质,用下图所示装置进行有关实验.
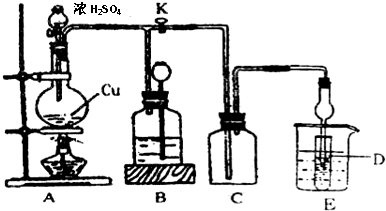
①装置B的作用是贮存多余的气体.B中应放置的液体是d(填序号).
a.饱和Na2SO3溶液 b.酸性 KMnO4溶液
c.浓溴水 d.饱和NaHSO3溶液
②反应完毕后,烧瓶中还有一定量的余酸,使用足量的下列药品不能用来证明反应结束后的烧瓶中的确有余酸的是b(填序号).
a.Fe粉b.BaCl2溶液 c.CuO d.Na2CO3溶液
③实验中某学生向A中反应后溶液中通入一种常见气体单质,使铜片全部溶解且仅生成硫酸铜溶液,该反应的化学方程式是2Cu+2H2SO4+O2=2CuSO4+2H2O.
④为验证二氧化硫的还原性,C中盛有氯水,充分反应后,取C中的溶液分成三份,分别进行如下实验:
方案I:向第一份溶液中加入AgNO3溶液,有白色沉淀生成
方案Ⅱ:向第二份溶液加入品红溶液,红色褪去
方案Ⅲ:向第三份溶液加入BaCl2溶液,产生白色沉淀
上述方案中合理的是Ⅲ(填“I”、“Ⅱ”或“Ⅲ”);C中发生反应的离子方程式为Cl2+SO2+2H2O=4H++2Cl-+SO42-.D中盛有氢氧化钠溶液,当通入二氧化硫至试管D中溶液显中性时,该溶液中c(Na+)=2 c(SO32-)+c(HSO3-)(用含硫微粒浓度的代数式表示).
(3)利用FeCl3溶液的氧化性也可以吸收SO2.
①该反应的离子方程式是2Fe3++SO2+2H2O=2Fe2++SO42-+4H+.检验FeCl3是否完全被还原的方法为取少量反应后的溶液滴加少量硫氰化钾溶液,若不变红则氯化铁完全被还原.
②为验证FeCl3溶液与SO2的反应:同学们将SO2通入0.05mol•L-1 FeCl3溶液中,溶液很快由黄色变为红褐色; 将溶液长时间放置后,最终变为浅绿色. 关于红褐色液体,以下是同学们的分析推测及实验.
利用胶体的丁达尔效应(填性质) 可以检验步骤ⅰ中是否得到了Fe(OH) 3胶体.
根据反应b,说明步骤ⅱ中液体颜色变化的原因是加入铁粉时发生反应2Fe3++Fe=3Fe2+,c(Fe3+)减小,使反应Fe3++6SO2?Fe(SO2)63+ 逆向移动(用离子方程式结合必要的文字说明).
(1)中学化学中利用物质与浓硫酸共热可制备SO2气体,写出用浓硫酸还可制备不同类别的气体的名称:乙烯(写一种).
(2)某化学兴趣小组为探究铜与浓硫酸的反应以及SO2的性质,用下图所示装置进行有关实验.

①装置B的作用是贮存多余的气体.B中应放置的液体是d(填序号).
a.饱和Na2SO3溶液 b.酸性 KMnO4溶液
c.浓溴水 d.饱和NaHSO3溶液
②反应完毕后,烧瓶中还有一定量的余酸,使用足量的下列药品不能用来证明反应结束后的烧瓶中的确有余酸的是b(填序号).
a.Fe粉b.BaCl2溶液 c.CuO d.Na2CO3溶液
③实验中某学生向A中反应后溶液中通入一种常见气体单质,使铜片全部溶解且仅生成硫酸铜溶液,该反应的化学方程式是2Cu+2H2SO4+O2=2CuSO4+2H2O.
④为验证二氧化硫的还原性,C中盛有氯水,充分反应后,取C中的溶液分成三份,分别进行如下实验:
方案I:向第一份溶液中加入AgNO3溶液,有白色沉淀生成
方案Ⅱ:向第二份溶液加入品红溶液,红色褪去
方案Ⅲ:向第三份溶液加入BaCl2溶液,产生白色沉淀
上述方案中合理的是Ⅲ(填“I”、“Ⅱ”或“Ⅲ”);C中发生反应的离子方程式为Cl2+SO2+2H2O=4H++2Cl-+SO42-.D中盛有氢氧化钠溶液,当通入二氧化硫至试管D中溶液显中性时,该溶液中c(Na+)=2 c(SO32-)+c(HSO3-)(用含硫微粒浓度的代数式表示).
(3)利用FeCl3溶液的氧化性也可以吸收SO2.
①该反应的离子方程式是2Fe3++SO2+2H2O=2Fe2++SO42-+4H+.检验FeCl3是否完全被还原的方法为取少量反应后的溶液滴加少量硫氰化钾溶液,若不变红则氯化铁完全被还原.
②为验证FeCl3溶液与SO2的反应:同学们将SO2通入0.05mol•L-1 FeCl3溶液中,溶液很快由黄色变为红褐色; 将溶液长时间放置后,最终变为浅绿色. 关于红褐色液体,以下是同学们的分析推测及实验.
| 分析推测 | 实验步骤及现象 |
| 甲:生成了Fe(OH) 3胶体 乙:经查阅资料,可能发生反应:Fe3++6SO2?Fe(SO2)63+ (反应b) | ⅰ.制备Fe(OH) 3胶体并检验 ⅱ.分别向Fe(OH) 3胶体和该红褐色液体中加入适量铁粉,振荡后前者不变色,后者变为浅绿色 |
根据反应b,说明步骤ⅱ中液体颜色变化的原因是加入铁粉时发生反应2Fe3++Fe=3Fe2+,c(Fe3+)减小,使反应Fe3++6SO2?Fe(SO2)63+ 逆向移动(用离子方程式结合必要的文字说明).
18.化学与生活密切相关.下列说法正确的是( )
| A. | 硅胶可作食品干燥剂 | B. | 计算机芯片的主要材料是SiO2 | ||
| C. | 糖类物质都属于高分子化合物 | D. | 地沟油和矿物油都属于酯类物质 |
2.下列关于乙烯(CH2=CH2)的说法不正确的( )
| A. | 乙烯分子中2个碳原子都是sp2杂化 | B. | 乙烯分子存在非极性键 | ||
| C. | 乙烯分子中4个H原子在同一平面上 | D. | 乙烯分子有6个σ键 |
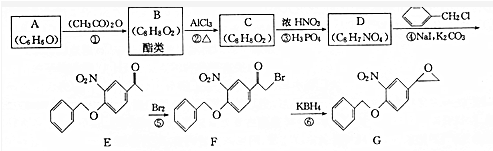
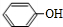 +(CH3CO)2O→
+(CH3CO)2O→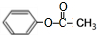 +CH3COOH.
+CH3COOH.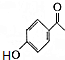 ;D的结构简式为
;D的结构简式为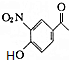 .
.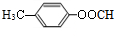 (填结构简式)
(填结构简式)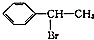 为起始原料制备
为起始原料制备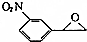 的合成路线:
的合成路线: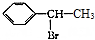 $→_{△}^{NaOH水溶液}$
$→_{△}^{NaOH水溶液}$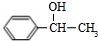 $→_{Cu/△}^{O_{2}}$
$→_{Cu/△}^{O_{2}}$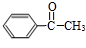 $→_{H_{3}PO_{4}}^{浓HNO_{3}}$
$→_{H_{3}PO_{4}}^{浓HNO_{3}}$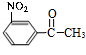 $\stackrel{NaBH_{4}}{→}$
$\stackrel{NaBH_{4}}{→}$
 的系统名称为2,2,4,6-四甲基-5-乙基辛烷.
的系统名称为2,2,4,6-四甲基-5-乙基辛烷.