题目内容
A、B、C、D、E五种短周期元素,它们的原子序数依次增大;A元素的离子不含电子;B元素的最高价氧化物对应水化物与其氢化物能反应生成盐F;D与A同主族,且与E同周期;E元素原子的最外层电子数是其次外层电子数的
,A、B、D、E这四种元素,每一种与C元素都能形成元素的原子个数比不相同的若干种化合物.请回答下列问题:
(1)E元素在元素周期表中的位置是 .
(2)由A、B、C三种元素形成的离子化合物的化学式为 .
(3)A、C、E间可形成甲、乙两种三原子分子,且甲有18个电子、乙有10个电子,甲与乙比较,沸点较高的是(填化学式) .
(4)F含有的化学键类型是 和 ,其水溶液呈酸性,请用相关的离子方程式解释其原因 .
(5)D和C形成的一种化合物能与A和C形成的一种化合物反应产生C单质,该过程的化学方程式为 .
| 3 |
| 4 |
(1)E元素在元素周期表中的位置是
(2)由A、B、C三种元素形成的离子化合物的化学式为
(3)A、C、E间可形成甲、乙两种三原子分子,且甲有18个电子、乙有10个电子,甲与乙比较,沸点较高的是(填化学式)
(4)F含有的化学键类型是
(5)D和C形成的一种化合物能与A和C形成的一种化合物反应产生C单质,该过程的化学方程式为
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:A、B、C、D、E五种短周期元素,它们的原子序数依次增大;A元素的离子不含电子,则A是H元素;B元素的最高价氧化物对应水化物与其氢化物能反应生成盐F,则B是N元素,F是NH4NO3;
D与A同主族且原子序数大于B,则D是Na元素,D与E同周期,则E位于第三周期;E元素原子的最外层电子数是其次外层电子数的
,则E最外层电子数是6,为S元素;
A、B、D、E这四种元素,每一种与C元素都能形成元素的原子个数比不相同的若干种化合物,则C是O元素;
再结合物质的性质、原子结构分析解答.
D与A同主族且原子序数大于B,则D是Na元素,D与E同周期,则E位于第三周期;E元素原子的最外层电子数是其次外层电子数的
| 3 |
| 4 |
A、B、D、E这四种元素,每一种与C元素都能形成元素的原子个数比不相同的若干种化合物,则C是O元素;
再结合物质的性质、原子结构分析解答.
解答:
解:A、B、C、D、E五种短周期元素,它们的原子序数依次增大;A元素的离子不含电子,则A是H元素;B元素的最高价氧化物对应水化物与其氢化物能反应生成盐F,则B是N元素,F是NH4NO3;
D与A同主族且原子序数大于B,则D是Na元素,D与E同周期,则E位于第三周期;E元素原子的最外层电子数是其次外层电子数的
,则E最外层电子数是6,为S元素;
A、B、D、E这四种元素,每一种与C元素都能形成元素的原子个数比不相同的若干种化合物,则C是O元素;
(1)E是S元素,S原子核外有3个电子层、最外层电子数是6,所以E元素在元素周期表中的位置是第三周期第VIA族,故答案为:三周期第VIA族;
(2)A、B、C分别是H、N、O,由A、B、C三种元素形成的离子化合物为硝酸铵或亚硝酸铵,硝酸铵或亚硝酸铵的化学式分别为NH4NO3、NH4NO2,故答案为:NH4NO3、NH4NO2;
(3)A、C、E分别是H、O、S元素,A、C、E间可形成甲、乙两种三原子分子,且甲有18个电子、乙有10个电子,则甲、乙分别是H2S、H2O,甲与乙比较,乙中含有氢键导致水的沸点升高,所以沸点较高的是(填化学式)H2O,故答案为:H2O;
(4)F为NH4NO3,F含有的化学键类型是离子键和共价键,硝酸铵为强酸弱碱盐,铵根离子水解而导致其水溶液呈酸性,水解方程式为NH4++H2O?NH3.H2O+OH-,故答案为:NH4++H2O?NH3.H2O+OH-;
(5)Na和O形成的一种化合物能与H和O形成的一种化合物反应产生O2,则这两种化合物分别 Na2O2、H2O,该过程的化学方程式为2 Na2O2+2H2O=4NaOH+O2↑,
故答案为:2 Na2O2+2H2O=4NaOH+O2↑.
D与A同主族且原子序数大于B,则D是Na元素,D与E同周期,则E位于第三周期;E元素原子的最外层电子数是其次外层电子数的
| 3 |
| 4 |
A、B、D、E这四种元素,每一种与C元素都能形成元素的原子个数比不相同的若干种化合物,则C是O元素;
(1)E是S元素,S原子核外有3个电子层、最外层电子数是6,所以E元素在元素周期表中的位置是第三周期第VIA族,故答案为:三周期第VIA族;
(2)A、B、C分别是H、N、O,由A、B、C三种元素形成的离子化合物为硝酸铵或亚硝酸铵,硝酸铵或亚硝酸铵的化学式分别为NH4NO3、NH4NO2,故答案为:NH4NO3、NH4NO2;
(3)A、C、E分别是H、O、S元素,A、C、E间可形成甲、乙两种三原子分子,且甲有18个电子、乙有10个电子,则甲、乙分别是H2S、H2O,甲与乙比较,乙中含有氢键导致水的沸点升高,所以沸点较高的是(填化学式)H2O,故答案为:H2O;
(4)F为NH4NO3,F含有的化学键类型是离子键和共价键,硝酸铵为强酸弱碱盐,铵根离子水解而导致其水溶液呈酸性,水解方程式为NH4++H2O?NH3.H2O+OH-,故答案为:NH4++H2O?NH3.H2O+OH-;
(5)Na和O形成的一种化合物能与H和O形成的一种化合物反应产生O2,则这两种化合物分别 Na2O2、H2O,该过程的化学方程式为2 Na2O2+2H2O=4NaOH+O2↑,
故答案为:2 Na2O2+2H2O=4NaOH+O2↑.
点评:本题考查了位置结构性质的关系及应用,涉及盐类水解、物质的结构、氢键、氧化还原反应等知识点,正确推断元素是解本题关键,同时考查学生灵活运用知识能力,注意:氢键只影响物质物理性质,不影响化学性质,氢键属于分子间作用力,不属于化学键.

练习册系列答案
相关题目
影响化学反应速率与平衡的因素有多方面,如浓度压强温度催化剂等.下列有关说法不正确的是( )
| A、其它条件不变时,改变压强能改变气体反应的速率,但不一定改变平衡 |
| B、增大浓度能加快化学反应速率,原因是增大浓度就增加了反应体系中活化分子的百分数 |
| C、温度升高使化学反应速率加快的主要原因是增加了反应体系中活化分子的百分数 |
| D、加入催化剂能降低反应所需的活化能,使反应速率加快,平衡常数增大 |
在100℃时,将N2O4、NO2分别充入两个各为1L的密闭容器中.发生反应;2NO2(g)?N2O4(g)△H<0.反应过程中浓度变化如下:下列说法正确的是( )
| 容器 | 物质 | 起始浓度/(mol?L-1 | 平衡浓度/(mol?L-1 |
| Ⅰ | N2O4 | 0.100 | 0.040 |
| NO2 | 0 | 0.120 | |
| Ⅱ | N2O4 | 0 | 0.014 |
| NO2 | 0.100 | 0.072 |
| A、平衡后,分别压缩容器Ⅰ、Ⅱ,则Ⅰ、Ⅱ中气体颜色都将变深 |
| B、平衡时,Ⅰ、Ⅱ中反应物的转化率a(N2O4)<a(NO2) |
| C、平衡时,Ⅰ、Ⅱ中反应的平衡常数K(Ⅰ)═2K(Ⅱ) |
| D、平衡后,升高相同温度,以N2O4表示的反应速率v(Ⅰ)<v(Ⅱ) |
 元素周期表揭示了化学元素间的内在联系,使其构成了一个完整的体系.
元素周期表揭示了化学元素间的内在联系,使其构成了一个完整的体系.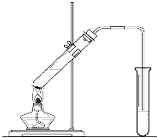 “酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如图所示的装置制取乙酸乙酯.回答下列问题:
“酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如图所示的装置制取乙酸乙酯.回答下列问题:
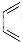 +
+ →G(抗病毒药阿昔洛韦中间体),G的结构简式为:
→G(抗病毒药阿昔洛韦中间体),G的结构简式为: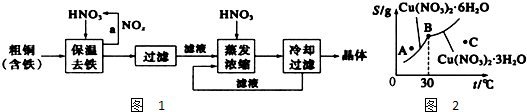
 黑火药爆炸时发生多种化学反应,其中主要化学反应方程式为:
黑火药爆炸时发生多种化学反应,其中主要化学反应方程式为: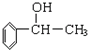 (1)苏合香醇可以用作食用香精,其结构简式如图所示.
(1)苏合香醇可以用作食用香精,其结构简式如图所示.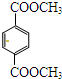 的同分异构体有多种,满足下列条件的共有
的同分异构体有多种,满足下列条件的共有