题目内容
20.乙烷-空气燃料电池是一种碱性燃料电池,电解质溶液是20~30%的KOH溶液.该燃料电池放电时,负极的电极反应式是C2H6-14e-+18OH-=2CO32-+12H2O;比起直接燃烧,燃料电池的主要优点是对环境无污染,能量利用率高.分析 乙烷-空气燃料电池放电时,负极上乙烷失电子和氢氧根离子反应生成CO32-和氮气,正极上氧气得电子和水反应生成氢氧根离子,据此分析解答.
解答 解:乙烷-空气燃料电池放电时,负极上乙烷失电子和氢氧根离子反应生成CO32-和氮气,正极上氧气得电子和水反应生成氢氧根离子,负极反应为C2H6-14e-+18OH-=2CO32-+12H2O,而直接燃烧会生成CO2 和H2O,对环境无污染,能量还会损失,利用率不高,燃料电池能量利用率高,不会污染环境,
故答案为:C2H6-14e-+18OH-=2CO32-+12H2O;对环境无污染,能量利用率高.
点评 本题考查电极反应式的书写,明确各个电极上发生的反应是解本题关键,注意要结合电解质溶液酸碱性书写电极反应式,注意能量利用率和环境问题,为考查重点.

练习册系列答案
相关题目
10. 1983年,福瑞堡大学的普林巴克(Prinzbach),合成多环有机分子.如图分子,因其形状像东方塔式庙宇(pagoda-style temple),所以该分子也就称为pagodane(庙宇烷),有关该分子的说法正确的是( )
1983年,福瑞堡大学的普林巴克(Prinzbach),合成多环有机分子.如图分子,因其形状像东方塔式庙宇(pagoda-style temple),所以该分子也就称为pagodane(庙宇烷),有关该分子的说法正确的是( )
 1983年,福瑞堡大学的普林巴克(Prinzbach),合成多环有机分子.如图分子,因其形状像东方塔式庙宇(pagoda-style temple),所以该分子也就称为pagodane(庙宇烷),有关该分子的说法正确的是( )
1983年,福瑞堡大学的普林巴克(Prinzbach),合成多环有机分子.如图分子,因其形状像东方塔式庙宇(pagoda-style temple),所以该分子也就称为pagodane(庙宇烷),有关该分子的说法正确的是( )| A. | 分子式为C20H24 | B. | 一氯代物的同分异构体只有三种 | ||
| C. | 分子中含有二个亚甲基(-CH2-) | D. | 分子中含有10个五元碳环 |
8.常温下,0.1mol•L-1的下列溶液中,有关微粒的物质的量浓度关系正确的是( )
| A. | NH4Cl溶液:c(Cl-)>c(NH4+)>c(OH-)>c(H+) | |
| B. | (NH4)2Fe(SO4)2溶液:c(SO42-)>c(NH4+)>c(Fe2+)>c(H+) | |
| C. | Na2CO3溶液:c(Na+)+c(H+)=c(CO32-)+c(HCO3-)+c(OH-) | |
| D. | NaHCO3溶液:c(H+)+c(H2CO3)=c(OH-)+c(CO32-) |
15.NA代表阿伏加德罗常数,下列叙述正确的是( )
| A. | 0.1 mol丙烯酸中含有双键的数目为0.1NA | |
| B. | 常温常压下,Cu、Zn、稀硫酸构成的原电池中,正极产生1.12 L H2时,转移的电子数应为0.1NA | |
| C. | 一定条件下定容容器中充入3molH2(g)和1 mol N2(g)发生反应:H2(g)+N2(g)?2NH3 (g);△H=-QkJ/mol,当该反应放出0.25QkJ的热量时,容器中的氢分子数共有2.75 NA | |
| D. | 在50 g质量分数为46%的乙醇水溶液中,含有的氢原子总数为6NA |
5.相同碳原子数的烷烃、烯烃、炔烃,在空气中完全燃烧生成二氧化碳和水,所需空气量的比较中正确的是
( )
( )
| A. | 烷烃最少 | B. | 烯烃最少 | C. | 炔烃最少 | D. | 三者一样多 |
12.下列有关分子晶体熔点高低的叙述中,正确的是( )
| A. | 氯气>碘单质 | B. | 四氯化硅>四氟化硅 | ||
| C. | NH3<PH3 | D. | 异戊烷>正戊烷 |
9.一些中草药中常存在下列四种香豆素类化合物.下列有关它们的说法中,正确的是( )
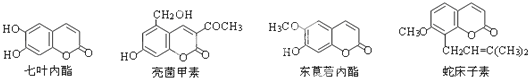
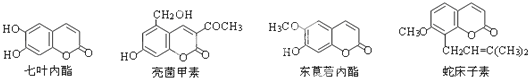
| A. | 它们均由C、H、O三种元素组成 | B. | 它们所含的官能团种类完全相同 | ||
| C. | 它们分子中均含有2个苯环 | D. | 七叶内酯与东莨菪内酯互为同系物 |