题目内容
14.下列各组分子中,都属于含有极性键的非极性分子的一组是( )| A. | CO2、H2O | B. | C2H4、CH4 | C. | Cl2、C2H2 | D. | N2H4、H2O2 |
分析 键的极性只看成键原子是否相同(相同为非极性键,不同为极性键);分子极性是指正负电荷重心是否重合,具体可以这样判断:如果是双原子分子那么键的极性就决定了分子极性;如果是ABn型就看这些键的极性能否抵消.
解答 解:A、CO2中的键为极性键,但由于二氧化碳的结构对称,故二氧化碳为非极性分子;水中的键为极性键,但由于水分子的结构不是线型结构,故水为极性分子,故A错误;
B、乙烯中的C-H为极性键,而乙烯为平面结构,故乙烯为非极性分子;甲烷中的C-H键为极性键,由于甲烷为正四面体结构,故甲烷为非极性分子,故B正确;
C、氯气中的键为非极性键,不含极性键,故C错误;
D、N2H4中的N-H键为极性键,由于结构对称,故为非极性分子;H2O2中的O-H键为极性键,且结构对称,故为非极性分子,故D正确.
故选BD.
点评 本题考查了极性键、非极性键和极性分子、非极性分子,应注意的是含极性键的不一定是极性分子,难度不大.

练习册系列答案
 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案
相关题目
4.用NA表示阿伏加德罗常数的值.下列叙述正确的是( )
| A. | 常温常压下,1molC2H4所含的电子数为12 NA | |
| B. | 标准状况下,16g甲烷中共价键数目为4NA | |
| C. | 常温常压,4 g氦气所含的核外电子数为4NA | |
| D. | 标准状况下,22.4L NO 与11.2L O2 充分反应后,所得的气体分子数一定为NA |
2.将煤粉隔绝空气加强热,除主要得到焦炭外,还能得到下表所列的物质:
(1)表中所列物质不属于有机物的是(填序号):②⑦.
(2)能与溴水反应使之褪色的烃是(填序号):③⑥⑦.
(3)彼此互为同系物的是(填序号):④⑤.
(4)能发生加聚反应、生成物可用作制造食品包装袋的是(填序号)③,该物质发生加聚反应的化学方程式为: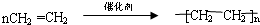 .
.
(5)甲苯的一氯取代产物有4种.
| 序号 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ |
| 名称 | 甲烷 | 一氧化碳 | 乙烯 | 苯 | 甲苯 | 苯酚 | 氨水 |
(2)能与溴水反应使之褪色的烃是(填序号):③⑥⑦.
(3)彼此互为同系物的是(填序号):④⑤.
(4)能发生加聚反应、生成物可用作制造食品包装袋的是(填序号)③,该物质发生加聚反应的化学方程式为:
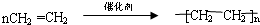 .
.(5)甲苯的一氯取代产物有4种.
19.X、Y、Z均为短周期元素,它们的原子核外最外层电子数分别为1、6、6,Z位于Y的上一周期,则这三种元素形成的某种化合物的化学式可能为( )
| A. | X2YZ4 | B. | XY2Z3 | C. | X3YZ4 | D. | XYZ3 |
6.某烃的结构简式为 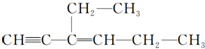 分子中处于四面体结构中心的碳原子数为a,一定处在同一平面内的碳原子数为b,一定处在同一直线上的碳原子数为c,则a、b、c依次为( )
分子中处于四面体结构中心的碳原子数为a,一定处在同一平面内的碳原子数为b,一定处在同一直线上的碳原子数为c,则a、b、c依次为( )
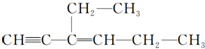 分子中处于四面体结构中心的碳原子数为a,一定处在同一平面内的碳原子数为b,一定处在同一直线上的碳原子数为c,则a、b、c依次为( )
分子中处于四面体结构中心的碳原子数为a,一定处在同一平面内的碳原子数为b,一定处在同一直线上的碳原子数为c,则a、b、c依次为( )| A. | 4、5、3 | B. | 4、6、3 | C. | 2、4、5 | D. | 4、4、6 |
3.下列说法或表述不正确的是( )
| A. | 常温下,某溶液水电离出的氢离子浓度是10-4 mol•L-1,则该溶液的PH可能是10 | |
| B. | 常温时,向硝酸钠溶液中滴加稀盐酸得到pH=4的混合溶液,则c(Na+)=c(NO3-) | |
| C. | 常温下,某溶液水电离出的氢离子浓度是10-10 mol•L-1,则该溶液的PH可能是10 | |
| D. | 常温下,PH值之和为14的醋酸和烧碱溶液,等体积混合后,溶液PH>7 |
4.常温、常压下,50ml三种气态烃的混合物与足量的氧气混合后点燃爆炸,恢复到原来状况时,体积共缩小100ml,则三种烃可能是( )
| A. | CH4、C2H6、C3H4 | B. | C2H6、C3H6、C4H6 | C. | CH4、C2H6、C3H8 | D. | C2H4、C2H6、C2H2 |