题目内容
3.将PH=3的醋酸和硫酸,分别用蒸馏水稀释至原溶液体积的a倍和b倍,稀释后两溶液的PH仍相等,则a和b的关系是( )| A. | a>b | B. | a<b | C. | a=b | D. | 无法确定 |
分析 醋酸是弱电解质,加水稀释有利于电离平衡正向移动,而硫酸是强电解质,不存在电离平衡,以此解答该题.
解答 解:因为醋酸是弱酸,加水后反应正向进行,醋酸电离度增加,加水后,氢离子浓度在减小的过程中氢离子的物质的量增大,而硫酸是强酸在水中完全电离,加水后,氢离子浓度只是在减小,氢离子的物质的量不变,所以要使稀释后两溶液pH值相同,则醋酸的体积比硫酸的体积要大,就必须使a>b,
故选A.
点评 本题考查了稀释对强弱电解质的不同影响,为高频考点,侧重于学生的分析能力的考查,注意加水稀释,弱电解质的电离平衡会向右移动,题目难度不大.

练习册系列答案
相关题目
7.下列各组离子在溶液中能大量共存的是( )
| A. | Na+、OH-、S2O${\;}_{3}^{2-}$、Cl- | B. | Fe2+、K+、H+、NO${\;}_{3}^{-}$ | ||
| C. | H+、C2O${\;}_{4}^{2-}$、MnO${\;}_{4}^{-}$、SO${\;}_{4}^{2-}$ | D. | Na+、Ca2+、AlO${\;}_{2}^{-}$、HCO${\;}_{3}^{-}$ |
14.在Na2O2与CO2的反应中,被氧化元素与被还原元素的质量比是( )
| A. | 1:1 | B. | 1:2 | C. | 2:1 | D. | 8:53 |
11.下列关于物质性质的叙述中,正确的是( )
| A. | 硫是一种淡黄色的能溶于水的晶体,既有氧化性又有还原性 | |
| B. | N2是大气中的主要成分之一,雷雨时,可直接转化为NO2 | |
| C. | Cl2能与金属活动顺序表中大多数金属反应 | |
| D. | 硅是应用广泛的半导体材料,常温下化学性质活泼 |
12.常温下,将0.1mol•L-1氢氧化钠溶液与0.06mol•L-1硫酸溶液等体积混合,该混合溶液的pH等于( )lg2=0.3.
| A. | 1.7 | B. | 2.0 | C. | 12.0 | D. | 11.7 |
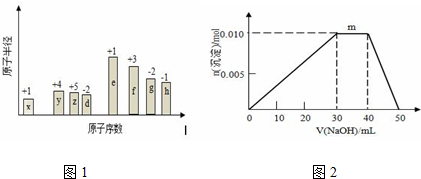

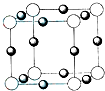 X、Y、Z、W、U五种元素,均位于周期表的前四周期,它们的核电荷数依次增加,且核电荷数之和为57.Y原子的L层p轨道中有2个电子,Z的原子核外有三个未成对电子,W与Y原子的价电子数相同,U原子的K层电子数与最外层电子数之比为2:1,其d轨道处于全充满状态.
X、Y、Z、W、U五种元素,均位于周期表的前四周期,它们的核电荷数依次增加,且核电荷数之和为57.Y原子的L层p轨道中有2个电子,Z的原子核外有三个未成对电子,W与Y原子的价电子数相同,U原子的K层电子数与最外层电子数之比为2:1,其d轨道处于全充满状态.