题目内容
8.某化学兴趣小组在实验室制取漂白粉,并探究氯气与石灰乳反应的条件和产物.已知:①二氧化锰与浓盐酸反应可制备氯气,同时生成MnCl2.②氯气和碱的反应为放热反应.温度较高时,氯气和碱还能发生如下反应:3Cl2+6OH-$\frac{\underline{\;\;△\;\;}}{\;}$5Cl-+ClO3-+3H2O.该兴趣小组设计了如图1实验装置,进行实验.
请回答下列问题:
(1)①甲装置用于制备氯气,其反应的化学方程式是MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;乙装置的作用是除去氯气中混有的氯化氢.
②该兴趣小组用100mL 12mol/L盐酸与 8.7gMnO2制备氯气,并将所得氯气与过量的石灰乳反应,则理论上最多可制得Ca(ClO)27.15g.
(2)小组成员发现,产物中Ca(ClO)2的质量明显小于理论值.为了探究反应条件对产物的影响,他们另取一定量的石灰乳,缓慢.匀速地通入足量氯气,得出了ClO-、ClO3-两种离子的物质的量(n)与反应时(t)的关系曲线,粗略表示为图2(不考虑氯气和水的反应).
①图中曲线I表示ClO-离子的物质的量随反应时间变化的关系.
②所取石灰乳中含有Ca(OH)2的物质的量为0.25mol.
(3)为了提高Ca(ClO)2的产率,可对丙装置作适当改进.请你给出一种改进方法:将丙装置浸在盛有冷水的水槽中.
分析 (1)①饱和食盐水的主要作用是除去氯气中的氯化氢气体;
②依据MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;2Cl2+2Ca(OH)2═CaCl2+Ca(ClO)2+2H2O,结合定量关系计算理论值;
(2)①当温度低时,氯气和氢氧化钙反应生成氯化钙和次氯酸钙;当温度高时,生成氯酸钙和氯化钙,根据温度高低来判断属于哪种离子;
②根据氧化还原反应中得失电子数相等计算氯离子的物质的量,然后根据含氯化合物中钙离子和阴离子的个数比计算氢氧化钙的物质的量;
(3)根据题中信息,在高温度下发生副反应,可以把丙装置放入冰水中.
解答 解:(1)①浓盐酸和二氧化锰反应制取氯气的方程式为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;反应过程中会发出氯化氢气体,所以通过饱和食盐水的作用是除去Cl2中混有的HCl气体,
故答案为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;除去氯气中混有的氯化氢;
②足量的浓盐酸与8.7g MnO2制备氯气,并将所得氯气与过量的石灰乳反应,则理论上最多可制得Ca(ClO)2;可以依据反应MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;2Cl2+2Ca(OH)2═CaCl2+Ca(ClO)2+2H2O,得到定量关系:8.7g MnO2物质的量为0.1mol;
2MnO2~Ca(ClO)2
2 1
0.1mol 0.05mol
所以理论上最多可制得Ca(ClO)2 质量=0.05mol×143g/mol=7.15g,
故答案为:7.15;
(2)①当温度低时,氯气和氢氧化钙反应生成氯化钙和次氯酸钙;当温度高时,生成氯酸钙和氯化钙,刚开始反应时,温度较低,氯气和氢氧化钙反应生成氯化钙和次氯酸钙,所以图2中曲线I表示离子ClO-的物质的量随反应时间变化的关系,
故答案为:ClO-;
②根据氧化还原反应中得失电子数相等计算Cl-的物质的量,设被还原的氯离子的物质的量为n,则n×1=0.10mol×1+0.05mol×5=0.35mol,含氯离子的物质的量为:0.35mol+0.1mol+0.05mol=0.5mol,氯化钙、次氯酸钙、氯酸钙中钙离子和含氯离子的个数比为1:2,所以所取石灰乳中含有Ca(OH)2的物质的量为0.25mol,
故答案为:0.25;
(3)由于反应在高温度下发生副反应,所以改进措施可以把丙装置放入冰水中,避免发生3Cl2+6OH-$\frac{\underline{\;\;△\;\;}}{\;}$5Cl-+ClO3-+3H2O,
故答案为:将丙装置浸在盛有冷水的水槽中.
点评 本题考查了性质方案的设计,题目难度中等,明确实验目的、实验原理为解答关键,注意熟练掌握氯气的实验室制法及守恒思想在化学计算中的应用方法是,他培养了学生的分析、理解能力及化学实验、化学计算能力.

| A. | 1mol甲基中含电子数目为10NA | |
| B. | 标准状况下,11.2L己烷所含有的分子数为0.5NA | |
| C. | 14g乙烯和丁烯的混合物中含有的原子总数为3NA个 | |
| D. | 常温下,4gCH4含有2NA个C-H共价键 |
 室温下向10mL 0.1mol•L-1NaOH溶液中加入0.1mol•L-1的一元酸HA,溶液pH的
室温下向10mL 0.1mol•L-1NaOH溶液中加入0.1mol•L-1的一元酸HA,溶液pH的变化曲线如图所示.下列说法正确的是( )
| A. | a点所示溶液中c(HA)>c(A-) | |
| B. | a点所示溶液中c(Na+)=c(A-)+c(HA) | |
| C. | 当加入HA溶液10ml时,$\frac{{K}_{w}}{c({H}^{+})}$<1.0×10-7mol•L-1 | |
| D. | b点所示溶液中c(Na+)>c(A-)>c(H+)>c(HA) |
| A. | a>b | B. | a<b | C. | a=b | D. | 无法确定 |
| A. | 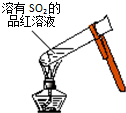 加热后溶液颜色变为无色 加热后溶液颜色变为无色 | |
| B. | 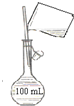 配制100 mL 0.10 mol•L-1NaCl溶液 配制100 mL 0.10 mol•L-1NaCl溶液 | |
| C. | 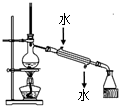 实验室用该装置制取少量蒸馏水 实验室用该装置制取少量蒸馏水 | |
| D. | 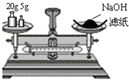 称量25 g NaOH 称量25 g NaOH |
| A. | 使石蕊试液变红 | |
| B. | 与铜反应生成Cu(NO3)2和NO气体 | |
| C. | 与Na2CO3反应放出CO2气体生成NaNO3 | |
| D. | 与C单质混合共热时生成CO2和NO2 |
| A. | 工业合成氨 | B. | 工业上用氨催化氧化法制备硝酸 | ||
| C. | 闪电导致雷雨中含有硝酸 | D. | 豆科植物的根瘤菌制造含氮化合物 |
 甲~辛等元素在周期表中的相对位置如下表.甲与戊的原子序数相差3,戊的一种单质是自然界硬度最大的物质,丁与辛属同周期元素,下列判断正确的是( )
甲~辛等元素在周期表中的相对位置如下表.甲与戊的原子序数相差3,戊的一种单质是自然界硬度最大的物质,丁与辛属同周期元素,下列判断正确的是( )| A. | 丙与庚的原子核外电子数相差3 | |
| B. | 原子半径:辛>己>戊 | |
| C. | 金属性:甲>乙>丁 | |
| D. | 乙的单质在空气中燃烧生成只含离子键的化合物 |