题目内容
7.实验室欲配制450mL 0.1mol/L NaCl溶液,其操作步骤可分解为以下几步:A.称取一定质量的氯化钠,放入烧杯中,用适量蒸馏水溶解.
B.用蒸馏水分成三次洗涤烧杯和玻璃棒,将每次洗涤液都倒入容量瓶里.
C.将氯化钠溶液小心地转移至容量瓶中.
D.检查容量瓶口是否发生滴漏.
E.将蒸馏水直接加入容量瓶,至液面接近环形刻度线2cm~3cm.
F.盖紧瓶塞,反复倾倒振荡,摇匀溶液.
G.用胶头滴管向容量瓶里逐滴滴入蒸馏水,至液面最低点恰好与环形刻度线相切.
请据此回答下列问题:
(1)实验时,应用托盘天平称取氯化钠晶体2.9g.
(2)在配制氯化钠溶液时需用的玻璃仪器主要有量筒、烧杯、玻璃棒、500mL容量瓶、胶头滴管.正确的操作顺序是DACBEFG.(填序号)
(3)若实验过程中遇到下列情况,则会造成所配溶液的浓度偏低的是AB.(填字母)
A.加水时越过刻度线 B.忘记将洗涤液加入容量瓶
C.容量瓶内壁附有水珠而未干燥处理 D.定容时俯视液面.
分析 (1)配制450mL 0.1mol/L NaCl溶液,应选择500mL容量瓶,实际配制500mL溶液,依据m=CVM计算需要溶质的质量;
(2)根据配制一定物质的量浓度的溶液的配制步骤选择需要的仪器;配制一定物质的量浓度的溶液的配制步骤:称量、溶解、移液、洗涤、定容、摇匀等,据此排序;
(3)根据c=$\frac{n}{V}$可得,一定物质的量浓度溶液配制的误差都是由溶质的物质的量n和溶液的体积V引起的,误差分析时,关键要看配制过程中引起n和V怎样的变化;若n比理论值小,或V比理论值大时,都会使所配溶液浓度偏小;若n比理论值大,或V比理论值小时,都会使所配溶液浓度偏大.
解答 解:(1)配制450mL 0.1mol/L NaCl溶液,应选择500mL容量瓶,实际配制500mL溶液,需要氯化钠质量m=0.1mol/L×0.5L×58.5g/mol=2.9g;
故答案为:2.9;
(2)溶液配制操作步骤有:称量、溶解、移液、洗涤、定容、摇匀等操作,一般用托盘天平称量,用药匙取药品,在烧杯中溶解,并用玻璃棒搅拌,冷却后转移到500ml容量瓶中,并用玻璃棒引流,洗涤并将该洗涤液移入容量瓶中,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,所以需要的仪器为:托盘天平、500mL容量瓶、胶头滴管、玻璃棒、烧杯、量筒、钥匙,
玻璃仪器有:500mL容量瓶、胶头滴管、玻璃棒、烧杯、量筒;
配制一定物质的量浓度的溶液的配制步骤:称量、溶解、移液、洗涤、定容、摇匀等,所以正确的操作顺序为:DACBEFG,
故答案为:500mL容量瓶、胶头滴管;DACBEFG;
(3)A.加水时越过刻度线,导致溶液体积偏大,溶液浓度偏低,故A选;
B.忘记将洗涤液加入容量瓶,导致溶质的物质的量偏小,溶液浓度偏低,故B选;
C.容量瓶内壁附有水珠而未干燥处理,对溶质的物质的量和溶液体积都不会产生影响,溶液浓度不变,故C不选;
D.定容时俯视液面,导致溶液体积偏小,溶液浓度偏高,个D不选;
故选:AB.
点评 本题考查了配制一定物质的量浓度的溶液的方法,明确配制原理和操作步骤是解题关键,注意误差分析的方法和技巧,侧重对学生能力的培养和解题方法的指导和训练.

| A. | 二氧化硫 | B. | 苯 | C. | 乙醇 | D. | 乙烷 |
| A. | H2SO4(aq)+2NaOH(aq)═Na2SO4(aq)+2H2O(l) | |
| B. | $\frac{1}{2}$H2SO4(aq)+$\frac{1}{2}$Ba(OH)2(aq)═BaSO4(s)+H2O(l) | |
| C. | HCl(aq)+NaOH(aq)═NaCl(aq)+H2O(l) | |
| D. | HCl(aq)+NH3•H2O(aq)═NH4Cl(aq)+H2O(l) |
| A. | 丙烷分子中3个碳原子一定在同一条直线上 | |
| B. | 甲苯分子中7个碳原子都在同一平面上 | |
| C. | 3-甲基-1-丁炔分子中所有碳原子都在同一平面上 | |
| D. | 2-丁烯分子中4个碳原子有可能在同一条直线上 |
| A. | 氮气的化学性质比氧气稳定 | |
| B. | 常温、常压下,溴呈液态,碘呈固态 | |
| C. | 稀有气体一般很难发生化学反应 | |
| D. | 相同状态下,氯气的密度比空气的大 |
| A. | 100mL容量瓶 | B. | 分液漏斗 | C. | 玻璃棒 | D. | 胶头滴管 |


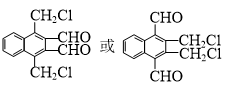 .
. )的衍生物,且取代基都在同一个苯环上;
)的衍生物,且取代基都在同一个苯环上; (R为烃基).根据已有知识并结合相关信息,写出以ClCH2CH2CH2Cl和
(R为烃基).根据已有知识并结合相关信息,写出以ClCH2CH2CH2Cl和 为原料制备
为原料制备 的合成路线流程图(无机试剂可任选).合成路线流程图示例如图所示:
的合成路线流程图(无机试剂可任选).合成路线流程图示例如图所示: