题目内容
8. (1)某同学用碳棒,铜棒,稀硫酸和干电池为原材料,实现了在通常条件下不能发生的反应:Cu+H2SO4(稀)=CuSO4+H2↑请在右边画出能够实验这一反应的装置图.
(1)某同学用碳棒,铜棒,稀硫酸和干电池为原材料,实现了在通常条件下不能发生的反应:Cu+H2SO4(稀)=CuSO4+H2↑请在右边画出能够实验这一反应的装置图.(2)某同学由于在做铜与稀硫酸的反应实验时操作出现失误,看到碳棒和铜棒上都有气泡产生且铜棒没有被腐蚀.请你分析其原因:两极与电源的正负极接反了(或铜棒接电源的负极了等).
分析 (1)Cu和稀硫酸不能自发进行,要使Cu+H2SO4(稀)=CuSO4+H2↑能发生,需要将该反应的装置设计成电解池,且Cu作阳极,可以用石墨作阴极,硫酸作电解质;
(2)如果将Cu、石墨与电源接反了,则Cu电极上得到氢气、石墨电极上得到氧气.
解答 解:(1)Cu和稀硫酸不能自发进行,要使Cu+H2SO4(稀)=CuSO4+H2↑能发生,需要将该反应的装置设计成电解池,且Cu作阳极,可以用石墨作阴极,硫酸作电解质,则该装置图为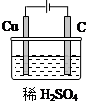 ,故答案为:
,故答案为: ;
;
(2)如果将Cu、石墨与电源接反了,则Cu作阴极、石墨作阳极,Cu电极上水得电子生成氢气、石墨电极上水失电子生成氧气,实质上是电解水,如果碳棒和铜棒上都有气泡产生且铜棒没有被腐蚀,原因是两极与电源的正负极接反了(或铜棒接电源的负极了等),
故答案为:两极与电源的正负极接反了(或铜棒接电源的负极了等).
点评 本题考查电解池设计,为高频考点,侧重考查学生综合知识应用能力,正确判断该反应能设计成哪种类型电池是解本题关键,注意:Cu和稀硫酸不反应,加热条件下能和浓硫酸反应,为易错题.

练习册系列答案
 寒假创新型自主学习第三学期寒假衔接系列答案
寒假创新型自主学习第三学期寒假衔接系列答案
相关题目
19.科技人员研究“变害为宝”的途径,以NO为原料通过电解制备NH4NO3.其工作原理如图所示,下列有关说法错误的是( )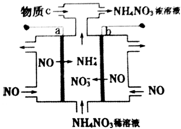

| A. | b为阳极,连接电源的正极 | |
| B. | 阴极反应式为3NO+15e-+18H+═3NH4++3H2O | |
| C. | 为使电解产物全部转化为NH4NO3,需补充的物质c为HNO3 | |
| D. | 总反应式为:8NO+7H2O$\frac{\underline{\;通电\;}}{\;}$3NH4NO3+2NHO3 |
16.下列化学用语或模型正确的是( )
| A. | CH3Cl  | B. | 2-氯甲苯的结构简式: | ||
| C. | 硝基苯的结构简式  | D. | CH4分子的球棍模型: |
13.有一支25mL酸式滴定管,其中所盛溶液液面恰好在5mL处.现将管内溶液全部排出并用量筒量得该溶液的体积为( )
| A. | 5mL | B. | 20mL | C. | >20mL | D. | <20mL |
20.下列电离方程式书写正确的是( )
| A. | H2SO4═H22++SO42- | B. | NaHCO3═Na++H++CO32- | ||
| C. | NaOH═Na++O2-+H+ | D. | Na2SO4═2Na++SO42- |
17.下列金属可用铝热法制备的是( )
①铁 ②镁 ③锰 ④钒 ⑤铬.
①铁 ②镁 ③锰 ④钒 ⑤铬.
| A. | ①②④ | B. | ①②③⑤ | C. | ①③④⑤ | D. | ①②③④⑤ |
18.含氮化合物的研发与绿色反展、经济可持续发展有着密切关联.
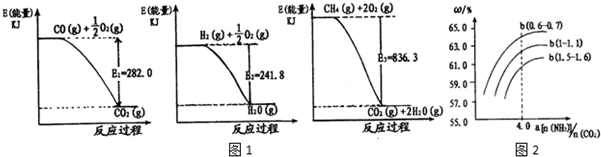
(1)氨是一种重要化工原料.合成氨原料气H2,可用天然气为原料制得,有关反应能量变化如图1所示.
则用CH4(g)和H20(g)反应制得H2(g)和CO(g)的热化学方程式为:CH4(g)+H2O(g)?CO(g)+3H2(g)△H=+171.1KJ/mol
(2)氮的氧化物有着广泛用途,又是环境的污染物.
(i)在150C时,将0.4mol NO2气体充人体积为2L的真空密闭容器中,发生反应:2NO2(g)-?N2O4(g).
每隔一定时间测定容器内各物质的物质的量,数据如表:
①当反应在1500C达到平衡时,该反应平衡常数K=2.8.(填数值)
②若最初通人N2O4,在相同条件下达到平衡时,各物质浓度仍然相同,则N2O4的起始浓度应为0.1mol/L.
(ii)氨氧化制HN03的尾气中含有NO和N02,且n(NO):n(N02)=1:1,可用尿素溶液除去,其作用原理是:N0和NO与水反应生成亚硝酸,亚硝酸再与尿素反应生成对环境无污染的物质.若用1mol尿素吸收该尾气,则能吸收氮氧化物76 g.
(3)氨气,CO2在一定条件下可合成尿素,其反应为:2NH3(g)+CO2(g)-CO( NH2)2(s)+H2O(g)
图2表示合成塔中氨碳比a与CO2转化率ω的关系.
a为[n(NH3)/n(CO2)],b为水碳比[n(H20)/n(CO2)].则:
①b应控制在C;
A.1.5.1.6 B.1~1.1 C.0.6~0.7
②a应控制在4.0的理由是氨碳比a[n(NH3)/n(CO2)]大于4.0时,增大氨气的物质的量,二氧化碳的转化率增加不大,增加了生产成本;氨碳比a[n(NH3)/n(CO2)]小于4.0时,二氧化碳的转化率较小.

(1)氨是一种重要化工原料.合成氨原料气H2,可用天然气为原料制得,有关反应能量变化如图1所示.
则用CH4(g)和H20(g)反应制得H2(g)和CO(g)的热化学方程式为:CH4(g)+H2O(g)?CO(g)+3H2(g)△H=+171.1KJ/mol
(2)氮的氧化物有着广泛用途,又是环境的污染物.
(i)在150C时,将0.4mol NO2气体充人体积为2L的真空密闭容器中,发生反应:2NO2(g)-?N2O4(g).
每隔一定时间测定容器内各物质的物质的量,数据如表:
| 时间 | 0 | 20 | 40 | 60 | 80 |
| n(NO2)/mol | 0.40 | n1 | 0.26 | n3 | n4 |
| n(N2O4)/mol | 0 | 0.05 | n2 | 0.08 | 0.08 |
②若最初通人N2O4,在相同条件下达到平衡时,各物质浓度仍然相同,则N2O4的起始浓度应为0.1mol/L.
(ii)氨氧化制HN03的尾气中含有NO和N02,且n(NO):n(N02)=1:1,可用尿素溶液除去,其作用原理是:N0和NO与水反应生成亚硝酸,亚硝酸再与尿素反应生成对环境无污染的物质.若用1mol尿素吸收该尾气,则能吸收氮氧化物76 g.
(3)氨气,CO2在一定条件下可合成尿素,其反应为:2NH3(g)+CO2(g)-CO( NH2)2(s)+H2O(g)
图2表示合成塔中氨碳比a与CO2转化率ω的关系.
a为[n(NH3)/n(CO2)],b为水碳比[n(H20)/n(CO2)].则:
①b应控制在C;
A.1.5.1.6 B.1~1.1 C.0.6~0.7
②a应控制在4.0的理由是氨碳比a[n(NH3)/n(CO2)]大于4.0时,增大氨气的物质的量,二氧化碳的转化率增加不大,增加了生产成本;氨碳比a[n(NH3)/n(CO2)]小于4.0时,二氧化碳的转化率较小.
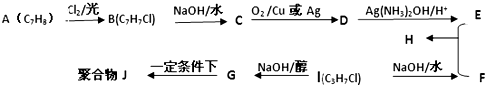
 ,C的官能团名称醇羟基.
,C的官能团名称醇羟基. .
. .
.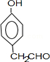 .
.