题目内容
19.科技人员研究“变害为宝”的途径,以NO为原料通过电解制备NH4NO3.其工作原理如图所示,下列有关说法错误的是( )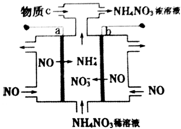
| A. | b为阳极,连接电源的正极 | |
| B. | 阴极反应式为3NO+15e-+18H+═3NH4++3H2O | |
| C. | 为使电解产物全部转化为NH4NO3,需补充的物质c为HNO3 | |
| D. | 总反应式为:8NO+7H2O$\frac{\underline{\;通电\;}}{\;}$3NH4NO3+2NHO3 |
分析 根据图知,a电极上NO得电子生成NH4+,说明a电极上得电子发生还原反应,为阴极,b电极上NO失电子生成NO3-,为阳极,
阳极反应为NO-3e-+2H2O=NO3-+4H+,阴极反应为:NO+5e-+6H+=NH4++H2O,从两极反应可看出,要使得失电子守恒,阳极产生的NO3-的物质的量大于阴极产生的NH4+的物质的量,总反应方程式为:8NO+7H2O$\frac{\underline{\;电解\;}}{\;}$3NH4NO3+2HNO3,因此若要使电解产物全部转化为NH4NO3,需补充NH3,据此分析解答.
解答 解:A.根据图知,a电极上NO得电子生成NH4+,则a为阴极,b电极上NO失电子生成NO3-,为阳极,阳极b连接原电池正极,故A正确;
B.阴极上得电子发生还原反应,电极反应式为3NO+15e-+18H+═3NH4++3H2O,故B正确;
C.阳极反应为NO-3e-+2H2O=NO3-+4H+,阴极反应为:NO+5e-+6H+=NH4++H2O,要使转移电子相等,生成的硝酸根离子物质的量大于生成铵根离子物质的量,所以电解产物全部转化为NH4NO3,需补充NH3,故C错误;
D.阳极反应为NO-3e-+2H2O=NO3-+4H+,阴极反应为:NO+5e-+6H+=NH4++H2O,所以电池反应式为8NO+7H2O$\frac{\underline{\;通电\;}}{\;}$3NH4NO3+2NHO3,故D正确;
故选C.
点评 本题考查电解原理,为高频考点,侧重考查学生分析判断及计算能力,明确各个电极上发生的反应是解本题关键,易错选项是C,要结合转移电子守恒分析解答,题目难度中等.

练习册系列答案
 手拉手全优练考卷系列答案
手拉手全优练考卷系列答案
相关题目
10.化学与生产、生活、社会密切相关.下列有关说法错误的是( )
| A. | 利用微生物发酵技术,将植物秸杆、动物粪便等制成沼气 | |
| B. | 大力推广农作物的生物防治技术,以减少农药的使用 | |
| C. | 氢氧燃料电池、硅太阳能电池中都利用了原电池原理 | |
| D. | 采用光触媒技术将汽车尾气中的NO和CO转化为无毒气体 |
14.短周期元素W、X、Y、Z的原子序数依次增大,X、Y、Z的简单离子的电子层结构相同,W与Y原子的最外层电子数之和为X原子的最外层电子数的2倍,Z原子的L层电子数比其最外层电子数多5,W是植物生长不可缺少的三种营养元素之一.下列说法正确的是( )
| A. | 单质的沸点:W>X | B. | Y的最高化合价为+7 | ||
| C. | 原子半径:r(W)<r(X)<r(Y)<r(Z) | D. | W、X、能存在于同一离子化合物中 |
4.某溶液中含有HCO3-、SO32-、Na+、NO3-四种离子,向其中加入足量的Na2O2固体后,假设溶液体积无变化,溶液中离子浓度基本保持不变的是( )
| A. | NO3- | B. | HCO3- | C. | Na+ | D. | SO32- |
11. 化学家们合成了一种新物质:五星烷,其键线式如图所示.下列关于五星烷的说法中正确的是( )
化学家们合成了一种新物质:五星烷,其键线式如图所示.下列关于五星烷的说法中正确的是( )
 化学家们合成了一种新物质:五星烷,其键线式如图所示.下列关于五星烷的说法中正确的是( )
化学家们合成了一种新物质:五星烷,其键线式如图所示.下列关于五星烷的说法中正确的是( )| A. | 五星烷与己烷互为同系物 | B. | 五星烷的化学式为C15H20 | ||
| C. | 五星烷分子中含有7个五元环 | D. | 五星烷的一氯代物有5种 |
9.某兴趣小组在网上收集到如下信息:钾、钙、钠、镁等活泼金属都能在CO2气体中燃烧.他们对钠在CO2气体中燃烧后生成的白色物质进行了如下探究:
[实验]将燃烧的钠迅速伸入到盛有装满CO2的集气瓶中,钠在其中继续燃烧至完全,反应后冷却,瓶底附着黑色颗粒,瓶壁上粘附着白色物质.
(1)通过钠在CO2气体中燃烧的实验,你认为物质燃烧的条件是有可燃物;有助燃剂(氧化剂);可燃物必须达到着火点.
(2)实验室不小心发生钠着火,下列灭火方法正确的是D
A.用水扑灭 B.用泡沫灭火器扑灭 C.用干粉灭火器扑灭 D.用砂子扑灭
[提出假设]
假设1:白色物质是Na2O.
假设2:白色物质是Na2CO3.
假设3:白色物质是Na2O和Na2CO3的混合物.
[设计实验方案.验证假设]该小组对燃烧后生成的白色物质进行如下探究:
[思考与交流]
(3)甲同学认为方案1得到的结论不正确,其理由是碳酸钠溶液水解显碱性,使酚酞变红.
(4)乙同学认为方案2得到的结论正确,白色物质为Na2CO3.理由是方案2的①中出现白色沉淀是BaCO3,所以燃烧后的白色物质中有Na2CO3,②中滴加无色酚酞试液无明显现象,说明燃烧后的白色固体中无Na2O.
(5)写出钠在二氧化碳中燃烧的化学方程式为4Na+3CO2=2Na2O2+C.
(6)丙同学认为白色物质有可能是氢氧化钠.你是否同意丙同学的观点,并简述理由:不同意,因为反应物中无氢元素.
[实验]将燃烧的钠迅速伸入到盛有装满CO2的集气瓶中,钠在其中继续燃烧至完全,反应后冷却,瓶底附着黑色颗粒,瓶壁上粘附着白色物质.
(1)通过钠在CO2气体中燃烧的实验,你认为物质燃烧的条件是有可燃物;有助燃剂(氧化剂);可燃物必须达到着火点.
(2)实验室不小心发生钠着火,下列灭火方法正确的是D
A.用水扑灭 B.用泡沫灭火器扑灭 C.用干粉灭火器扑灭 D.用砂子扑灭
[提出假设]
假设1:白色物质是Na2O.
假设2:白色物质是Na2CO3.
假设3:白色物质是Na2O和Na2CO3的混合物.
[设计实验方案.验证假设]该小组对燃烧后生成的白色物质进行如下探究:
| 实验方案 | 实验操作 | 实验现象 | 结论 |
| 方案1 | 取少量白色物质于试管中,加入适量水,振荡,样品全部溶于水,向其中加入无色酚酞试液 | 溶液变成红色 | 白色物质为Na2O |
| 方案2 | ①取少量白色物质于试管中,加入适量水,振荡,样品全部溶于水,向其中加入过量的BaCl2溶液 | 出现白色沉淀 | |
| ②静置片刻,取上层清液于试管中,滴加无色酚酞试液 | 无明显现象 |
(3)甲同学认为方案1得到的结论不正确,其理由是碳酸钠溶液水解显碱性,使酚酞变红.
(4)乙同学认为方案2得到的结论正确,白色物质为Na2CO3.理由是方案2的①中出现白色沉淀是BaCO3,所以燃烧后的白色物质中有Na2CO3,②中滴加无色酚酞试液无明显现象,说明燃烧后的白色固体中无Na2O.
(5)写出钠在二氧化碳中燃烧的化学方程式为4Na+3CO2=2Na2O2+C.
(6)丙同学认为白色物质有可能是氢氧化钠.你是否同意丙同学的观点,并简述理由:不同意,因为反应物中无氢元素.
 (1)某同学用碳棒,铜棒,稀硫酸和干电池为原材料,实现了在通常条件下不能发生的反应:Cu+H2SO4(稀)=CuSO4+H2↑请在右边画出能够实验这一反应的装置图.
(1)某同学用碳棒,铜棒,稀硫酸和干电池为原材料,实现了在通常条件下不能发生的反应:Cu+H2SO4(稀)=CuSO4+H2↑请在右边画出能够实验这一反应的装置图.