题目内容
 已知A、B、C、D和E都是元素周期表中前36号的元素,它们的原子序数依次增大.A与其他4种元素既不在同一周期又不在同一主族.B和C属同一主族,D和E属同一周期,又知E是周期表中1-18列中的第7列元素.D的原子序数比E小5,D跟B可形成离子化合物其晶胞结构如图.
已知A、B、C、D和E都是元素周期表中前36号的元素,它们的原子序数依次增大.A与其他4种元素既不在同一周期又不在同一主族.B和C属同一主族,D和E属同一周期,又知E是周期表中1-18列中的第7列元素.D的原子序数比E小5,D跟B可形成离子化合物其晶胞结构如图.(1)从图中可以看出,D跟B形成的离子化合物的化学式为
(2)该离子化合物晶体的密度为ag?cm-3,则晶胞的体积是
考点:晶胞的计算,位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题,化学键与晶体结构
分析:从D、E是周期表中1-18列中E排第7列可判断E是第4周期VIIB族的Mn元素,原子序数为25,所以D也在第4周期,D的原子序数比E小5,则原子序数为20,应为Ca元素,图中离子化合物D与B的离子个数比值为:(8×
+6×
):8=1:2,且D为Ca,则B的化合价为-1价,应为第ⅦA族元素,B和C属同一主族,B的序数在前面,B为F,C为Cl;A与其他4种元素既不在同一周期又不在同一主族,所以A为H.
(1)利用均摊法计算化学式;
(2)根据ρ=
计算晶胞的体积.
| 1 |
| 8 |
| 1 |
| 2 |
(1)利用均摊法计算化学式;
(2)根据ρ=
| m |
| V |
解答:
解:从D、E是周期表中1-18列中E排第7列可判断E是第4周期VIIB族的Mn元素,原子序数为25,所以D也在第4周期,D的原子序数比E小5,则原子序数为20,应为Ca元素,图中离子化合物D与B的离子个数比值为:(8×
+6×
):8=1:2,且D为Ca,则B的化合价为-1价,应为第ⅦA族元素,B和C属同一主族,B的序数在前面,B为F,C为Cl;A与其他4种元素既不在同一周期又不在同一主族,所以A为H.
(1)从图中可以看出,晶胞中含有Ca的离子个数为:(8×
+6×
)=4,含有F的离子个数为8,二者比值为1:2,则化学式为CaF2,故答案为:CaF2;
(2)晶胞中根据上面的计算可知,有4个钙离子和8个氟离子,所以ρ=
=
=ag?cm-3,则V=
,故答案为:
.
| 1 |
| 8 |
| 1 |
| 2 |
(1)从图中可以看出,晶胞中含有Ca的离子个数为:(8×
| 1 |
| 8 |
| 1 |
| 2 |
(2)晶胞中根据上面的计算可知,有4个钙离子和8个氟离子,所以ρ=
| m |
| V |
| ||
| V |
| 4×78g/mol |
| ag?cm-3×6.02×1023/mol |
| 4×78g/mol |
| ag?cm-3×6.02×1023/mol |
点评:本题以元素推断为基础,考查了有化学式的确定、晶胞密度的计算等问题,题目难度不大,答题时注意均摊法的应用,注意观察晶胞结构.

练习册系列答案
相关题目
下列离子方程式书写正确的是( )
| A、氢氧化铁溶于氢碘酸:Fe(OH)3+3H+═Fe3++3H2O |
| B、氯气溶于水:Cl2+H2O=2H++ClO-+Cl- |
| C、溴化亚铁溶液中通入足量氯气:2Fe2++4Br-+3Cl2═2Fe3++2Br2+6Cl- |
| D、向硫酸铝铵[NH4Al(SO4)2]溶液中滴加少量Ba(OH)2溶液:Al3++2SO42-+2Ba2++4OH-═AlO2-+2BaSO4↓+2H2O |
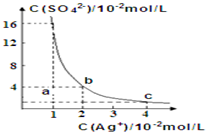 某温度时,Ag2SO4在水溶液中的沉淀溶解平衡曲线如图所示:下列有关Ag2SO4说法正确的是( )
某温度时,Ag2SO4在水溶液中的沉淀溶解平衡曲线如图所示:下列有关Ag2SO4说法正确的是( )| A、含有大量SO42-的溶液中肯定不存在Ag+ |
| B、Ag2SO4的溶度积常数(Ksp)为8×10-4 |
| C、a点表示Ag2SO4的不饱和溶液,蒸发可以使溶液由a点变到b点 |
| D、0.02mol?L-1的AgNO3溶液与0.2mol?L-1的Na2SO4溶液等体积混合不会生成沉淀 |
在已经处于化学平衡的体系中,如果下列量发生变化,化学平衡一定发生了移动的是( )
| A、反应混合物的浓度 |
| B、反应体系的压强 |
| C、正、逆反应的速率 |
| D、反应体系的温度 |



