题目内容
无水CuSO4在强热下会发生分解反应:
CuSO4
CuO+SO3↑ 2SO3
2SO2↑+O2↑
某研究性学习小组设计了如图所示装置(夹持仪器已略去),利用D管在反应前后的质量差计算分解的无水CuSO4的质量.
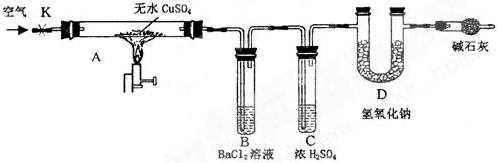
实验步骤:
①称量反应前D管的质量.
②连接好装置,关闭K,加热硬质玻璃管A一定时间后,停止加热.
③待硬质玻璃管A冷却后,打开K,通入一段时间的空气.
④再称量D管,得其反应前后的质量差为m.
(1)B管中出现的现象是 .有关离子方程式是
(2)B管的作用是除去混合气体中的SO3,实验过程中发现B管的温度明显升高,主要原因是
(3)按上述方法实验,假设B、C、D对气体的吸收均完全,并忽略空气中CO2的影响,能否根据m计算分解的无水CuSO4的质量? 原因是 .
CuSO4
| ||
| 强热 |
某研究性学习小组设计了如图所示装置(夹持仪器已略去),利用D管在反应前后的质量差计算分解的无水CuSO4的质量.

实验步骤:
①称量反应前D管的质量.
②连接好装置,关闭K,加热硬质玻璃管A一定时间后,停止加热.
③待硬质玻璃管A冷却后,打开K,通入一段时间的空气.
④再称量D管,得其反应前后的质量差为m.
(1)B管中出现的现象是
(2)B管的作用是除去混合气体中的SO3,实验过程中发现B管的温度明显升高,主要原因是
(3)按上述方法实验,假设B、C、D对气体的吸收均完全,并忽略空气中CO2的影响,能否根据m计算分解的无水CuSO4的质量?
考点:性质实验方案的设计
专题:实验设计题
分析:(1)硫酸铜受热分解生成产物中含有三氧化硫、二氧化硫和氧气,所以B中会看到白色沉淀生成和气泡冒出;硫酸和氯化钡反应生成硫酸钡沉淀;
(2)温度升高是三氧化硫溶于水生成硫酸放出的热量;
(3)无水硫酸铜在强热下会发生分解反应:CuSO4
CuO+SO3↑ 2SO3
2SO2↑+O2↑,因为三氧化硫分解是可逆反应,则SO3不能完全分解为SO2和O2,并且SO2会部分溶解在溶液中,无法测定,所以根据m不能计算分解的无水CuSO4的质量.
(2)温度升高是三氧化硫溶于水生成硫酸放出的热量;
(3)无水硫酸铜在强热下会发生分解反应:CuSO4
| ||
| △ |
解答:
解:(1)硫酸铜受热分解生成产物中含有三氧化硫、二氧化硫和氧气,所以B中会看到白色沉淀生成和气泡冒出;硫酸和氯化钡反应生成硫酸钡沉淀,反应的离子方程式为SO3+H2O+Ba2+=BaSO4↓+2H+或SO3+H2O=2H++SO42-和Ba2++SO42-=BaSO4↓,
故答案为:有气泡冒出,产生白色沉淀;SO3+H2O+Ba2+=BaSO4↓+2H+或SO3+H2O=2H++SO42-和Ba2++SO42-=BaSO4↓;
(2)温度升高是三氧化硫溶于水生成硫酸放出的热量,故答案为:SO3溶于水放热;
(3)因为三氧化硫分解是可逆反应,则SO3不能完全分解为SO2和O2,并且SO2会部分溶解在溶液中,无法测定,所以根据m不能计算分解的无水CuSO4的质量.
故答案为:不能;SO3不能完全分解为SO2和O2,并且SO2会部分溶解在溶液中.
故答案为:有气泡冒出,产生白色沉淀;SO3+H2O+Ba2+=BaSO4↓+2H+或SO3+H2O=2H++SO42-和Ba2++SO42-=BaSO4↓;
(2)温度升高是三氧化硫溶于水生成硫酸放出的热量,故答案为:SO3溶于水放热;
(3)因为三氧化硫分解是可逆反应,则SO3不能完全分解为SO2和O2,并且SO2会部分溶解在溶液中,无法测定,所以根据m不能计算分解的无水CuSO4的质量.
故答案为:不能;SO3不能完全分解为SO2和O2,并且SO2会部分溶解在溶液中.
点评:本题考查了物质反应产物的实验分析设计,实验测定的步骤分析判断,生成物的性质分析应用,掌握基础是解题关键,题目难度中等.

练习册系列答案
 全优点练单元计划系列答案
全优点练单元计划系列答案
相关题目
以下有关元素性质的说法不正确的是( )
| A、具有下列电子排布式的原子中,①1s22s22p63s23p2②1s22s22p3 ③1s22s22p2 ④1s22s22p63s23p4 原子半径最大的是① |
| B、具有下列价电子排布式的原子中,①3s23p1 ②3s23p2 ③3s23p3 ④3s23p4,第一电离能最大的是③ |
| C、①Na、K、Rb ②O、S、Se ③Na、P、Cl,元素的电负性随原子序数增大而递增的是③ |
| D、某元素气态基态原子的逐级电离能分别为738、1451、7733、10540、13630、17995、21703,当它与氯气反应时可能生成的阳离子是X3+ |
已知N元素最低化合价是-3价,最高化合价是+5价,那么下列物质中的N元素只具有氧化性的是( )
| A、NH3 |
| B、N2 |
| C、NO2 |
| D、HNO3 |
将甘油溶解于甲苯中得到一混合物,若其中碳元素的质量分数为50%,那么氧元素的质量分数为( )
| A、41.3% | B、8.7% |
| C、1.74% | D、无法计算 |
已知:①H2O(g)═H2O(l)△H1=-Q1 kJ?mol-1
②CH3OH(g)═CH3OH(l)△H2=-Q2 kJ?mol-1
③2CH3OH(g)+3O2(g)═2CO2(g)+4H2O(g)△H3=-Q3 kJ?mol-1(Q1、Q2、Q3均大于0)
若要使32g液态甲醇完全燃烧,最后恢复到室温,放出的热量为(单位:kJ)( )
②CH3OH(g)═CH3OH(l)△H2=-Q2 kJ?mol-1
③2CH3OH(g)+3O2(g)═2CO2(g)+4H2O(g)△H3=-Q3 kJ?mol-1(Q1、Q2、Q3均大于0)
若要使32g液态甲醇完全燃烧,最后恢复到室温,放出的热量为(单位:kJ)( )
| A、Q1+Q2+Q3 |
| B、0.5Q3-Q2+2Q1 |
| C、0.5Q3+Q2-2Q1 |
| D、0.5(Q1+Q2+Q3) |
 (1)某晶体的晶胞如图所示,X位于体心,Y位于6面心,Z位于顶点,该晶体中 X、Y、Z的粒子个数比为
(1)某晶体的晶胞如图所示,X位于体心,Y位于6面心,Z位于顶点,该晶体中 X、Y、Z的粒子个数比为