题目内容
设NA为阿伏加德罗常数的值.下列说法正确的是( )
| A、常温常压下,15g甲基(-CH3)中所含的中子数为6NA |
| B、一定条件下Fe粉与足量的浓硫酸反应,转移电子数为3NA |
| C、在1 L的碳酸钠溶液中,若c(CO32-)=1 mol?L-1,则溶液中Na+的个数为2NA |
| D、含4NA个离子的固体Na2O2溶于水配成1 L溶液,所得溶液中Na+的物质的量浓度为2 mol?L-1 |
考点:阿伏加德罗常数
专题:阿伏加德罗常数和阿伏加德罗定律
分析:A.一个甲基中含有6个中子;
B.常温下,铁和浓硫酸发生钝化现象;
C.碳酸根离子为弱酸根离子,部分发生水解;
D.1个过氧化钠含有2个钠离子和1个过氧根离子.
B.常温下,铁和浓硫酸发生钝化现象;
C.碳酸根离子为弱酸根离子,部分发生水解;
D.1个过氧化钠含有2个钠离子和1个过氧根离子.
解答:
解:A.一个甲基中含有6个中子,15g甲基(-CH3)的物质的量=
,所以15g甲基(-CH3)所含的中子数为6NA,故A正确;
B.常温下,铁和浓硫酸发生钝化现象,阻止了铁进一步和浓硫酸发生氧化还原反应,故B错误;
C.碳酸根离子为弱酸根离子,部分发生水解,在1 L的碳酸钠溶液中,若c(CO32-)=1 mol?L-1,则溶液中Na+的个数大于2NA,故C错误;
D.4NA个离子的固体Na2O2与水反应生成氢氧化钠含有钠离子小于2mol,所得溶液中Na+的物质的量浓度小于2 mol?L-1,故D错误;
故选:A.
| 15g |
| 15g/mol |
B.常温下,铁和浓硫酸发生钝化现象,阻止了铁进一步和浓硫酸发生氧化还原反应,故B错误;
C.碳酸根离子为弱酸根离子,部分发生水解,在1 L的碳酸钠溶液中,若c(CO32-)=1 mol?L-1,则溶液中Na+的个数大于2NA,故C错误;
D.4NA个离子的固体Na2O2与水反应生成氢氧化钠含有钠离子小于2mol,所得溶液中Na+的物质的量浓度小于2 mol?L-1,故D错误;
故选:A.
点评:本题考查了阿伏伽德罗常数的分析应用,明确物质的结构及微粒数之间的换算是解题关键,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列比较正确的是( )
| A、离子半径:F -<Na+ |
| B、原子半径:Mg>Al |
| C、离子半径:Na+<Mg2+ |
| D、原子半径:N>P |
化学用语是表示物质组成、结构和变化规律的一种具有国际性、科学性和规范性的书面语言.下列化学用语中,书写错误的是( )
A、硫离子的结构示意图: |
B、NH4Cl的电子式: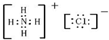 |
C、CO2的电子式: |
| D、次氯酸的结构式:H-O-Cl |
下列指定反应的离子方程式正确的是( )
| A、向Na2SiO3溶液中通入过量CO2:SiO32-+CO2+H2O═H2SiO3↓+CO32- |
| B、酸性介质中KMnO4氧化H2O2:2MnO4-+5H2O2+6H+═2Mn2++5O2↑+8H2O |
| C、等物质的量的MgCl2、Ba(OH)2 和 HC1 溶液混合:Mg2++2OH-═Mg(OH)2↓ |
| D、用CH3COOH溶解CaCO3:CaCO3+2H+═Ca2++H2O+CO2↑ |






