题目内容
13.某元素R的气态氢化物的化学式为HxR,在标准状况下,8.5克HxR气体的体积是5.6L,将5.1克HxR气体通入200ml0.75mol/L的CuSO4溶液中恰好完全反应.已知R原子核内质子数等于中子数.(1)HxR的相对分子质量为34.
(2)试通过计算求x的值,并确定R元素的名称.
分析 (1)根据n=$\frac{V}{{V}_{m}}$计算HxR气体的物质的量,再结合M=$\frac{m}{n}$计算相对分子质量;
(2)5.1gHxR气体的物质的量为0.15mol,CuSO4的物质的量也是0.15mol,二者等物质的量反应,则发生反应:HxR+CuCl2═CuR↓+2HCl,结合原子守恒计算x的值,进而确定R元素.
解答 解:(1)标况下,HxR气体的物质的量=$\frac{5.6L}{22.4L/mol}$=0.25mol,则其摩尔质量=$\frac{8.5g}{0.25mol}$=34g/mol,摩尔质量在数值上等于其相对分子质量,所以其相对分子质量为34.
故答案为:34;
(2)n(HxR)=$\frac{5.1g}{34g/mol}$=0.15mol,而200mL 0.75mol•L-1的CuCl2溶液中氯化铜的物质的量为:0.2L×0.75mol•L-1=0.15mol,二者等物质的量反应,则HxR+CuCl2═CuR↓+2HCl,由氢元素和氯元素质量守恒可知x=2,则Ar(R)=34-2=32,故R原子的质量数为32,R的质子数和中子数均为16,R为硫元素,
答:x为2,R为硫元素.
点评 本题考查物质的量有关计算、化学方程式计算以及质子数与中子数、质量数之间的关系等知识点,难度不大,注意对基础知识的掌握.

练习册系列答案
 新题型全程检测期末冲刺100分系列答案
新题型全程检测期末冲刺100分系列答案
相关题目
3.根据热化学方程式S(l)+O2(g)═SO2(g)△H=-293.23kJmol-1,分析下列说法中正确的是( )
| A. | 1mol固体S单质燃烧放出的热量大于293.23 kJ | |
| B. | 1mol气体S单质燃烧放出的热量小于293.23 kJ | |
| C. | 1 mol SO2(g)的键能的总和大于1 mol S(l)和1 mol O2(g)的键能之和 | |
| D. | 1 mol SO2(g)的键能的总和小于1 mol S(l)和1 mol O2(g)的键能之和 |
8.在元素周期表中位于金属和非金属元素的交界处,容易找到的元素是( )
| A. | 制备催化剂的元素 | B. | 耐高温的合金元素 | ||
| C. | 用于半导体材料的元素 | D. | 制备农药的元素 |
18.“绿色化学”特点之一是:提高原子的利用率,力图使所有作为原料的原子都被产品所消纳,实现“零排放”.以下反应不符合绿色化学原子经济性要求的是( )
| A. | 乙烯在银作催化剂的条件下与氧气反应生成环氧乙烷 | |
| B. | 乙烯水化法制乙醇 | |
| C. | 乙烯与氯化氢加成制氯乙烷 | |
| D. | 利用乙烯与氢气加成制得的乙烷与氯气在光照条件下制氯乙烷 |
5.物质溶于水的过程中通常伴随着能量的变化,表为四种物质的溶解热(“+”为放热,“-”为吸热):
将等质量的上述物质加入等质量的水中,对水的电离平衡影响最小的是( )
| 化学式 | NH4NO3 | NaOH | NaCl | KNO3 |
| 溶解热(kJ/kg) | -330.75 | +1040.5 | -84.10 | -353.17 |
| A. | NH4NO3 | B. | NaOH | C. | NaCl | D. | KNO3 |
2.下列反应的离子方程式正确的是( )
| A. | 硫酸与氢氧化钡溶液反应:H++OH-═H2O | |
| B. | 稀H2SO4与铁粉反应:2Fe+6H+═2Fe3++3H2↑ | |
| C. | 氯气通入水中:Cl2+H2O?2H++Cl-+ClO- | |
| D. | AlCl3溶液中加入足量的氨水:Al3++3NH3•H2O═Al(OH)3↓+3NH4+ |
3.下列有关实验的操作和设计正确的是( )
| A. | 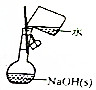 配制0.10mol•L-1的NaOH溶液 配制0.10mol•L-1的NaOH溶液 | |
| B. | 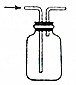 在实验室中用排空气法收集CO2 在实验室中用排空气法收集CO2 | |
| C. | 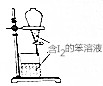 用苯萃取碘水中的碘,分出水层后的操作 用苯萃取碘水中的碘,分出水层后的操作 | |
| D. | 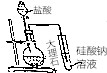 比较Cl,C,Si三种元素的非金属性强弱 比较Cl,C,Si三种元素的非金属性强弱 |