题目内容
2.下列是有关0.1mol/L醋酸钡溶液微粒浓度的比较,其中错误的是( )| A. | c(CH3COO-)>c(Ba2+)>c(OH-)>c(H+) | B. | c(H+)+c(Ba2+)=c(CH3COO-)+c(OH-) | ||
| C. | c(OH-)═c(H+)+c(CH3COO-) | D. | 2c(Ba2+)=c(CH3COO-)+c(CH3COOH) |
分析 A.CH3COO-离子水解程度较小,水解后溶液呈碱性,c(CH3COO-)>c(Ba2+);
B.从溶液的电中性角度考虑;
C.根据溶液电中性和物料守恒分析;
D.根据溶液中的物料守恒分析.
解答 解:A.CH3COO-离子水解程度较小,水解后溶液呈碱性,由(CH3COO)2Ba可知,则有c(CH3COO-)>c(Ba2+),c(OH-)>c(H+),正确的顺序应为,c(CH3COO-)>c(Ba2+)>c(OH-)>c(H+),故A正确;
B.溶液呈电中性,溶液中阳离子所带电荷等于阴离子所带电荷,则c(H+)+2c(Ba2+)=c(CH3COO-)+c(OH-),故B错误;
C.根据溶液电中性可知:c(H+)+2c(Ba2+)=c(OH-)+c(CH3COO-),根据物料守恒可知,c(CH3COOH)+c(CH3COO-)=2c(Ba2+),则有c(H+)+c(CH3COOH)+c(CH3COO-)=c(OH-)+c(CH3COO-),即c(H+)=c(OH-)-c(CH3COOH),故C正确;
D.由(CH3COO)2Ba,根据物料守恒可知:c(CH3COOH)+c(CH3COO-)=2c(Ba2+),故D正确;
故选B.
点评 本题考查溶液中离子浓度大小计较,题目难度中等,做题时注意从电荷守恒、物料守恒的角度着手分析,试题培养了学生的分析能力及灵活应用.

练习册系列答案
相关题目
11.工业上以铬铁矿(主要成分为FeO•Cr2O3)、碳酸钠、氧气和硫酸为原料生产重铬酸钠(Na2Cr2O7•2H2O),其主要反应为:
(1)4FeO•Cr2O3+8Na2CO3+7O2$\frac{\underline{\;通电\;}}{\;}$8Na2CrO4+2Fe2O3+8CO2
(2)2Na2CrO4+H2SO4?Na2SO4+Na2Cr2O7+H2O
下列说法中正确的是( )
(1)4FeO•Cr2O3+8Na2CO3+7O2$\frac{\underline{\;通电\;}}{\;}$8Na2CrO4+2Fe2O3+8CO2
(2)2Na2CrO4+H2SO4?Na2SO4+Na2Cr2O7+H2O
下列说法中正确的是( )
| A. | 反应(1)和(2)均为氧化还原反应 | |
| B. | 反应(1)的氧化剂是O2,还原剂是FeO•Cr2O3 | |
| C. | 高温下,O2的氧化性大于Fe2O3小于Na2CrO4 | |
| D. | 生成1mol的Na2Cr2O7时共转移5mol电子 |
10.有两种气态不饱和烃的混合物1体积,完全燃烧后可得3.8体积CO2和3.6体积水蒸气(气体体积均在相同条件下测定),则这两种烃是( )
| A. | C2H4、C4H6 | B. | C2H2、C4H8 | C. | C3H4、C4H8 | D. | C3H4、C3H6 |
7.下列说法正确的是( )
| A. | 某试样焰色反应呈黄色,则试样中肯定不含有K+ | |
| B. | 过滤操作时,为了加快过滤可以用玻璃棒搅拌漏斗的液体 | |
| C. | 蒸馏装置中,温度计水银球的位置应该在蒸馏烧瓶的支管口附近 | |
| D. | 粗盐的提纯实验中,滤液在坩埚中加热蒸发结晶 |
14.两种气态单质按下列反应X2(g)+Y2(g)?2XY(g),X2与Y2按一定比例混合,在不同温度下经一定时间反应,混合物中X2的体积分数变化如图所示,试确定该反应是吸热反应还是放热反应放热反应.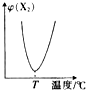

11.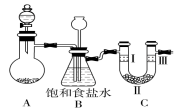 某学习小组围绕氯气设计了一系列实验.
某学习小组围绕氯气设计了一系列实验.
(1)用如图装置A制备氯气.选用的药品为漂粉精固体和浓盐酸,相关的化学方程式为Ca(ClO)2+4HCl(浓)═CaCl2+2Cl2↑+2H2O.
(2)装置B中饱和食盐水的作用是除氯气中的氯化氢;同时装置B也是安全瓶,监测实验进行时C中是否发生堵塞,请写出发生堵塞时B中的现象:B中长颈漏斗下端导管中液面会上升,形成水柱.
(3)为检验氯气是否具有漂白性,使氯气依次通过Ⅰ、Ⅱ、Ⅲ三种物质,物质的顺序正确的是D.
(4)为了进一步比较氧化性强弱,将一定量氯气通入溴化亚铁溶液后,再加入四氯化碳,振荡,静置,整个过程中肯定能观察到的现象是A.
A.水层显棕黄色 B.水层无色C.四氯化碳层显红棕色 D.四氯化碳层无色
(5)查阅资料后小组发现,氯气、浓硝酸、酸性高锰酸钾等都是常用的强氧化剂,但工业上氧化卤水中的I-选择了价格并不便宜的亚硝酸钠,排除环境方面的因素,可能的原因是:氯气、浓硝酸、酸性高锰酸钾等氧化性太强,还能继续氧化碘单质.
(6)有人提出,工业上为防止污染空气,可用足量的Na2SO3溶液吸收余氯,试写出相应的离子方程式:Cl2+SO32-+H2O=SO42-+2H++Cl-.判断改用NaHSO3溶液是否可行:否(填“是”或“否”).
 某学习小组围绕氯气设计了一系列实验.
某学习小组围绕氯气设计了一系列实验.(1)用如图装置A制备氯气.选用的药品为漂粉精固体和浓盐酸,相关的化学方程式为Ca(ClO)2+4HCl(浓)═CaCl2+2Cl2↑+2H2O.
(2)装置B中饱和食盐水的作用是除氯气中的氯化氢;同时装置B也是安全瓶,监测实验进行时C中是否发生堵塞,请写出发生堵塞时B中的现象:B中长颈漏斗下端导管中液面会上升,形成水柱.
(3)为检验氯气是否具有漂白性,使氯气依次通过Ⅰ、Ⅱ、Ⅲ三种物质,物质的顺序正确的是D.
| A | B | C | D | |
| Ⅰ | 干燥的有色布条 | 干燥的有色布条 | 湿润的有色布条 | 湿润的有色布条 |
| Ⅱ | 碱石灰 | 硅胶 | 浓硫酸 | 无水氯化钙 |
| Ⅲ | 湿润的有色布条 | 湿润的有色布条 | 干燥的有色布条 | 干燥的有色布条 |
A.水层显棕黄色 B.水层无色C.四氯化碳层显红棕色 D.四氯化碳层无色
(5)查阅资料后小组发现,氯气、浓硝酸、酸性高锰酸钾等都是常用的强氧化剂,但工业上氧化卤水中的I-选择了价格并不便宜的亚硝酸钠,排除环境方面的因素,可能的原因是:氯气、浓硝酸、酸性高锰酸钾等氧化性太强,还能继续氧化碘单质.
(6)有人提出,工业上为防止污染空气,可用足量的Na2SO3溶液吸收余氯,试写出相应的离子方程式:Cl2+SO32-+H2O=SO42-+2H++Cl-.判断改用NaHSO3溶液是否可行:否(填“是”或“否”).
12.下列离子方程式的书写及评价均合理的是( )
| 选项 | 离子方程式 | 评价 |
| A | 将2molC l2通入到含1mol FeI2的溶液中:2Fe2++2I-+2Cl2=2Fe3++4Cl-+I2 | 正确;Cl2过量,可将Fe2+、 I-均氧化 |
| B | Ba(HCO3)2溶液与足量的NaOH溶液反应:B a2++HCO3-+OH-=B aCO3↓+H2O | 正确;酸式盐与碱反应生成正盐和水 |
| C | 1mol•L-1的Na[Al(OH)4]溶液和2.5mol•L-1的HCl溶液等体积互相均匀混合:2[Al(OH)4]-+5H+=A l3++Al(OH)3↓+5H2O | 正确;[Al(OH)4]-与Al(OH)3消耗的H+的物质的量之比为2:3 |
| D | 过量SO2通入到NaClO溶液中:SO2+H2O+ClO-=HClO+HSO3- | 正确;说明酸性:H2SO3强于HClO |
| A. | A | B. | B | C. | C | D. | D |