题目内容
 A、B、C、D、E都是元素周期表中前20号元素,其原子序数依次增大.B、C、D同周期,A、D同主族,E和其它元素既不在同周期也不在同主族.B、C、D的最高价氧化物的水化物均能互相反应生成盐和水,D的原子半径是同周期原子中最小的.
A、B、C、D、E都是元素周期表中前20号元素,其原子序数依次增大.B、C、D同周期,A、D同主族,E和其它元素既不在同周期也不在同主族.B、C、D的最高价氧化物的水化物均能互相反应生成盐和水,D的原子半径是同周期原子中最小的.根据以上信息,回答下列问题:
(1)上述A、B、C、D四种元素中第一电离能最小的是
(2)A和D的氢化物中,沸点较高的是
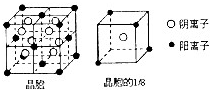
(3)A和E可形成离子化合物,其晶胞结构如图所示:则每个晶胞中含阳离子的数目为
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题,化学键与晶体结构
分析:A、B、C、D、E都是元素周期表中前20号元素,其原子序数依次增大,B、C、D同周期,A、D同主族,E和其它元素既不在同周期也不在同主族,B、C、D的最高价氧化物的水化物均能互相反应生成盐和水,则C的最高价氧化物的水化物是两性氢氧化物,为Al(OH)3,所以C是Al元素,B的最高价氧化物的水化物是强碱,D的最高价氧化物的水化物是强酸,且B、C、D同一周期,所以B是Na元素,D的原子半径是同周期原子中最小,则D是Cl元素,E与其它元素既不同一周期又不同一主族,且原子序数最大,所以E是Ca元素,A和D同一主族,则A是F元素,再结合物质结构、性质解答.
解答:
解:A、B、C、D、E都是元素周期表中前20号元素,其原子序数依次增大,B、C、D同周期,A、D同主族,E和其它元素既不在同周期也不在同主族,B、C、D的最高价氧化物的水化物均能互相反应生成盐和水,则C的最高价氧化物的水化物是两性氢氧化物,为Al(OH)3,所以C是Al元素,B的最高价氧化物的水化物是强碱,D的最高价氧化物的水化物是强酸,且B、C、D同一周期,所以B是Na元素,D的原子半径是同周期原子中最小,则D是Cl元素,E与其它元素既不同一周期又不同一主族,且原子序数最大,所以E是Ca元素,A和D同一主族,则A是F元素,
(1)通过以上分析知,A、B、C、D分别是F、Na、Al、Cl元素,同一周期元素中,元素的第一电离能随着原子序数的增大而呈增大趋势,同一主族中,元素的第一电离能随着原子序数的增大而减小,所以A、B、C、D四种元素的第一电离能最小的是Na元素,元素的非金属性越强其电负性越强,所以电负性最大的是F元素,原子的电子层数越多其原子半径越大,同一周期元素中,原子半径随着原子序数的增大而减小,所以其原子半径大小顺序是F<Cl<Al<Na,
故答案为:Na; F;F<Cl<Al<Na;
(2)A、D的氢化物分别是HF、HCl,因为HF中存在氢键导致HF的沸点较高,
故答案为:HF;因为HF分子间存在氢键;
(3)F、Ca元素形成离子化合物,该晶胞中钙离子个数=8×
+6×
=4,氟离子个数=8,所以该晶胞中钙离子、氟离子个数之比=4:8=1:2,其化学式为CaF2,
故答案为:4;8;CaF2.
(1)通过以上分析知,A、B、C、D分别是F、Na、Al、Cl元素,同一周期元素中,元素的第一电离能随着原子序数的增大而呈增大趋势,同一主族中,元素的第一电离能随着原子序数的增大而减小,所以A、B、C、D四种元素的第一电离能最小的是Na元素,元素的非金属性越强其电负性越强,所以电负性最大的是F元素,原子的电子层数越多其原子半径越大,同一周期元素中,原子半径随着原子序数的增大而减小,所以其原子半径大小顺序是F<Cl<Al<Na,
故答案为:Na; F;F<Cl<Al<Na;
(2)A、D的氢化物分别是HF、HCl,因为HF中存在氢键导致HF的沸点较高,
故答案为:HF;因为HF分子间存在氢键;
(3)F、Ca元素形成离子化合物,该晶胞中钙离子个数=8×
| 1 |
| 8 |
| 1 |
| 2 |
故答案为:4;8;CaF2.
点评:本题考查了元素位置结构性质的相互关系及应用,涉及元素推断、晶体的计算、元素周期律等知识点,根据原子结构、物质性质确定元素,再结合均摊法、元素周期律等知识点来分析解答,题目难度不大.

练习册系列答案
相关题目
乙酸的下列性质中,可以证明它是弱电解质的是( )
| A、1mol/L乙酸溶液的pH约为3 |
| B、乙酸能与水以任何比例互溶 |
| C、10mL1mol/L乙酸恰好与10mL1mol/LNaOH溶液完全反应 |
| D、同温同浓度的乙酸溶液的导电性比硫酸溶液的弱 |
下列电离方程式书写错误的是( )
| A、Na2CO3=2Na++CO32- |
| B、NaHSO4=Na++H++SO42- |
| C、H2SO4=H++SO42- |
| D、KClO3=K++ClO3- |
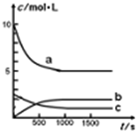 一定温度下,在体积为1L的恒容密闭容器中充入10mol NO2和2.5molO2发生反应:4NO2(g)+O2(g)?2N2O5(g)△H<0.反应混合物中NO2和物质的量浓度随时间的变化如表所示:
一定温度下,在体积为1L的恒容密闭容器中充入10mol NO2和2.5molO2发生反应:4NO2(g)+O2(g)?2N2O5(g)△H<0.反应混合物中NO2和物质的量浓度随时间的变化如表所示: 系统命名为
系统命名为