题目内容
食醋的总酸量即一定体积的食醋原液所含醋酸的质量,单位是g?L-1或g/100mL.国家标准规定酿造食醋总酸含量不得低于3.5g/100mL.
(1)用酸碱滴定法测定某食醋样品中的总酸量时,下列说法中正确的是 (双选).
A.用NaOH溶液滴定时反应的离子方程式为H++OH-=H2O
B.食醋样品通常需要预先稀释一定倍数后再进行滴定
C.用NaOH溶液滴定时,可使用酚酞或甲基橙作指示剂
D.若测得样品的物质的量浓度为0.75mol?L-1,则其总酸量为45g?L-1
(2)某同学仔细观察该食醋样品的标签,发现其中还含有作为食品添加剂的苯甲酸钠(C6H5COONa),他想用理论验证醋酸与苯甲酸钠不会发生离子互换反应,需查找在一定温度下醋酸与苯甲酸的 .
A.pH B.电离度 C.电离常数 D.溶解度
(3)常温下,用0.1000mol?L-1 NaOH溶液分别滴定20.00mL 0.1000mol?L-1 HCl溶液和20.00mL 0.1000mol?L-1 CH3COOH溶液,得到两条滴定曲线,如图所示.

①滴定醋酸溶液的曲线是 (填“图1”或“图2”);滴定曲线中a= mL;
②E点pH>8的原因是(用离子方程式表示): .
(4)测定食醋的总酸量实验中,配制NaOH溶液和稀释食醋所用的蒸馏水必须煮沸,目的是 .
(5)实验时,吸取食醋样品10mL于100mL容量瓶中定容.移取定容后的溶液20mL于锥形瓶中,加入1~2滴指示剂,用浓度为c mol?L-1的NaOH标准溶液滴定,平行测定三次,消耗NaOH溶液的平均体积为V mL.则原食醋样品的总酸量= g/100mL.
(1)用酸碱滴定法测定某食醋样品中的总酸量时,下列说法中正确的是
A.用NaOH溶液滴定时反应的离子方程式为H++OH-=H2O
B.食醋样品通常需要预先稀释一定倍数后再进行滴定
C.用NaOH溶液滴定时,可使用酚酞或甲基橙作指示剂
D.若测得样品的物质的量浓度为0.75mol?L-1,则其总酸量为45g?L-1
(2)某同学仔细观察该食醋样品的标签,发现其中还含有作为食品添加剂的苯甲酸钠(C6H5COONa),他想用理论验证醋酸与苯甲酸钠不会发生离子互换反应,需查找在一定温度下醋酸与苯甲酸的
A.pH B.电离度 C.电离常数 D.溶解度
(3)常温下,用0.1000mol?L-1 NaOH溶液分别滴定20.00mL 0.1000mol?L-1 HCl溶液和20.00mL 0.1000mol?L-1 CH3COOH溶液,得到两条滴定曲线,如图所示.

①滴定醋酸溶液的曲线是
②E点pH>8的原因是(用离子方程式表示):
(4)测定食醋的总酸量实验中,配制NaOH溶液和稀释食醋所用的蒸馏水必须煮沸,目的是
(5)实验时,吸取食醋样品10mL于100mL容量瓶中定容.移取定容后的溶液20mL于锥形瓶中,加入1~2滴指示剂,用浓度为c mol?L-1的NaOH标准溶液滴定,平行测定三次,消耗NaOH溶液的平均体积为V mL.则原食醋样品的总酸量=
考点:中和滴定,弱电解质在水溶液中的电离平衡
专题:实验题
分析:(1)A.醋酸为弱电解质,离子方程式中应写为化学式;
B.实验时,为减小误差,应降低溶液的浓度;
C.不能用甲基橙为酸碱指示剂;
D.食醋的物质的量浓度为0.75mol?L-1,总酸量为0.75mol?L-1×60g/mol=45g/L;
(2)根据电离常数判断酸的强弱,然后依据强酸制弱酸来分析;
(3)①醋酸为弱电解质,0.1mol/L的醋酸溶液的pH大于1,据此可以判断图2正确;根据图1计算出a值;
②E点时氢氧化钠与醋酸反应生成醋酸钠,醋酸根离子水解,溶液显示碱性;
(4)根据水中溶解二氧化碳,二氧化碳能与氢氧化钠反应,影响测定结果;
(5)根据白醋与NaOH 溶液反应的关系式来解答;
B.实验时,为减小误差,应降低溶液的浓度;
C.不能用甲基橙为酸碱指示剂;
D.食醋的物质的量浓度为0.75mol?L-1,总酸量为0.75mol?L-1×60g/mol=45g/L;
(2)根据电离常数判断酸的强弱,然后依据强酸制弱酸来分析;
(3)①醋酸为弱电解质,0.1mol/L的醋酸溶液的pH大于1,据此可以判断图2正确;根据图1计算出a值;
②E点时氢氧化钠与醋酸反应生成醋酸钠,醋酸根离子水解,溶液显示碱性;
(4)根据水中溶解二氧化碳,二氧化碳能与氢氧化钠反应,影响测定结果;
(5)根据白醋与NaOH 溶液反应的关系式来解答;
解答:
解:(1)A.醋酸为弱电解质,离子方程式应为CH3COOH+OH-=CH3COO++H2O,故A错误;
B.食醋试样需稀释一定倍数后再进行滴定,目的为减小实验误差,故B正确;
C.醋酸为弱电解质,滴定终点时,溶液呈碱性,不能用甲基橙为酸碱指示剂,否则误差较大,故C错误;
D.食醋的物质的量浓度为0.75mol?L-1,总酸量为0.75mol?L-1×60g/mol=45g/L,故D正确;
故选:BD;
(2)电离常数决定酸电离难易程度,由电离常数判断酸的强弱,进而判断反应能否发生,其他选项不能判断酸的强弱,故选C;
(3)①醋酸为弱电解质,醋酸为弱酸,氯化氢为强电解质,0.1mol/L的盐酸溶液的pH=1,而0.1mol/L的醋酸溶液的pH一定大于1,根据图象中氢氧化钠溶液体积为0时溶液的pH可知,滴定醋酸溶液的曲线是图2;根据图1中氯化氢与氢氧化钠等物质的量时,溶液为中性,则a点时盐酸的体积为20.00mL,
故答案为:图2;20.00;
②醋酸钠为强碱弱酸盐,醋酸根离子水解,溶液呈碱性,水解的离子方程式为:CH3COO-+H2O?CH3COOH+OH-,
故答案为:CH3COO-+H2O?CH3COOH+OH-;
(4)水中溶解二氧化碳,二氧化碳能与氢氧化钠反应,影响测定结果,所以配制溶液所用的蒸馏水必须煮沸以除去溶解在水中的二氧化碳;
故答案为:除去溶解在水中的二氧化碳;
(5)设10mL市售白醋样品含有 CH3COOOH xg,则
CH3COOOH~NaOH
60 40
xg×0.2 cmol?L-1×V×10-3L×40g/mol
解得:x=0.3cV
则原食醋样品的总酸量=0.3cV×10=3cVg/100mL;
故答案为:3cV;
B.食醋试样需稀释一定倍数后再进行滴定,目的为减小实验误差,故B正确;
C.醋酸为弱电解质,滴定终点时,溶液呈碱性,不能用甲基橙为酸碱指示剂,否则误差较大,故C错误;
D.食醋的物质的量浓度为0.75mol?L-1,总酸量为0.75mol?L-1×60g/mol=45g/L,故D正确;
故选:BD;
(2)电离常数决定酸电离难易程度,由电离常数判断酸的强弱,进而判断反应能否发生,其他选项不能判断酸的强弱,故选C;
(3)①醋酸为弱电解质,醋酸为弱酸,氯化氢为强电解质,0.1mol/L的盐酸溶液的pH=1,而0.1mol/L的醋酸溶液的pH一定大于1,根据图象中氢氧化钠溶液体积为0时溶液的pH可知,滴定醋酸溶液的曲线是图2;根据图1中氯化氢与氢氧化钠等物质的量时,溶液为中性,则a点时盐酸的体积为20.00mL,
故答案为:图2;20.00;
②醋酸钠为强碱弱酸盐,醋酸根离子水解,溶液呈碱性,水解的离子方程式为:CH3COO-+H2O?CH3COOH+OH-,
故答案为:CH3COO-+H2O?CH3COOH+OH-;
(4)水中溶解二氧化碳,二氧化碳能与氢氧化钠反应,影响测定结果,所以配制溶液所用的蒸馏水必须煮沸以除去溶解在水中的二氧化碳;
故答案为:除去溶解在水中的二氧化碳;
(5)设10mL市售白醋样品含有 CH3COOOH xg,则
CH3COOOH~NaOH
60 40
xg×0.2 cmol?L-1×V×10-3L×40g/mol
解得:x=0.3cV
则原食醋样品的总酸量=0.3cV×10=3cVg/100mL;
故答案为:3cV;
点评:本题综合考查物质的含量测定、酸碱混合的定性判断和计算以及弱电解质的电离和盐类的水解等知识,题目难度中等,但信息量较大,答题时注意审题.

练习册系列答案
相关题目
在酸性溶液中,下列各组离子能大量共存且溶液为无色透明的是( )
| A、Na+、K+、OH-、Cl- |
| B、Na+、Cu2+、SO42-、NO3- |
| C、Mg2+、Na+、SO42-、Cl- |
| D、K+、Na+、NO3-、CO32- |
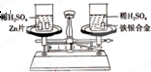 如图所示,在托盘天平的左右两托盘中各放置一只烧杯,调节天平使之平衡,向烧杯中分别注入足量且等质量、等浓度的稀硫酸,然后向两只烧杯中分别加入相同质量的锌片和铁银合金,反应完成后,天平仍保持平衡.合金中铁和银的质量比为( )
如图所示,在托盘天平的左右两托盘中各放置一只烧杯,调节天平使之平衡,向烧杯中分别注入足量且等质量、等浓度的稀硫酸,然后向两只烧杯中分别加入相同质量的锌片和铁银合金,反应完成后,天平仍保持平衡.合金中铁和银的质量比为( )| A、65:56 | B、56:108 |
| C、56:9 | D、65:9 |
下列物质的鉴别方法不正确的是( )
| A、利用丁达尔效应鉴别Fe(OH)3胶体与FeCl3溶液 |
| B、用氢氧化钠溶液鉴别MgCl2溶液、AlCl3溶液 |
| C、用焰色反应鉴别NaCl、KCl和Na2SO4 |
| D、用氯化钙溶液鉴别Na2CO3和NaHCO3两种溶液 |
下列叙述正确的是( )
| A、将氯化铁饱和溶液逐滴滴入氢氧化钠稀溶液中,边滴边搅拌,可获得氢氧化铁胶体 |
| B、不能用乙醇萃取碘水中的碘是因为碘在水中溶解度比在乙醇中大 |
| C、实验室可通过蒸馏的方法除去自来水中含有的氯离子等杂质制蒸馏水 |
| D、浓硫酸不慎溅到皮肤上,应该立即用大量水冲洗,然后涂上稀NaOH溶液 |
在密闭容器中的一定量混合气体发生反应:xA(g)+yB(g)?zC(g)平衡时测得A的浓度为0.60mol/L,保持温度不变,将容器的容积扩大到原来的两倍,再达平衡时,测得A的浓度降低为0.35mol/L.下列有关判断正确的是( )
| A、x+y<z |
| B、平衡向正反应方向移动 |
| C、B的转化率降低 |
| D、C的体积分数下降 |
某炔烃X加氢后,得CH3CH2CH(CH3)CH3,则X是( )
| A、2-甲基-1-丁炔 |
| B、3-甲基-1-丁炔 |
| C、2-甲基-2-丁炔 |
| D、1-戊炔 |